
人的记忆会随着时间的进展以及年龄的老去逐渐模糊,通常我们会采用影像及文字等形式留存住值得纪念的片刻时光。
在疾病的研究中,为了探索更针对性的个性化治疗方案,疾病进展期间和治疗期间的“记忆”如何被保存下来?一代又一代的科研工作者们又如何破解开这些“记忆”的密码,这是非常值得关注的问题。
医生们通常将手术切下来的样本制作成福尔马林固定石蜡包埋组织 FFPE(formalin-fixed paraffin-embedded),用于保存样本在不同时期的“记忆”,便于后续研究。FFPE 样本是生物医学研究珍贵的“记忆”库,蕴藏了非常多的有价值的信息。有研究表明 FFPE 样本中的蛋白质能够在数十年内保持稳定,非常适合做蛋白质组学(Proteomics)研究[1]。

珍贵的“记忆”库:FFPE样本

2015年,一篇关于结合 PCT 压力循环技术应用于蛋白质组学的文章发表在 Nature Medicine 上[2],西湖欧米创始人郭天南研究员独创的微量蛋白质组学方法得到学术界认可。自此,在蛋白质组学研究领域,PCT 技术开始高频地与“微量”概念绑定。
文章标题

PCT 技术是一种专门适用于微量样本的前处理技术,通过让FFPE组织样本接受“压力”,从而高效地破碎组织,提取蛋白。
基于PCT技术的微量样本蛋白质组学流程
PCT技术详解:欧米技术丨让蛋白质组感受压力:PCT 如何深度处理微量组织样本
近几年,郭天南团队不断对基于 PCT 的微量样本蛋白质组学方法进行优化,以期能够用更少的样本量鉴定到更多的蛋白质。2022年8月5日,此技术再次实现了升级。升级后的 PCT 前处理方法能够实现低至 0.1mg 极微量组织,以及针对细胞、粪便、泪液试纸等样本的高通量蛋白质组分析,该方法非常适合 FFPE 石蜡样本和活检穿刺样本的临床大队列蛋白质组学研究[3]。

最新 PCT 微量样本蛋白质组方法学文章
西湖欧米 PCT 微量样本蛋白质组学优势
(1) 无缝体系:将组织裂解-蛋白质提取-酶解消化集成一体,尽可能减少因样本转移带来的损失。
(2) 极少样本量:最低可达 0.1 mg 组织分析。
(3) 高重现性:每个步骤精确控制,最大限度地减少技术误差,CV<20%。
(4) 高深度鉴定量:文章数据表明,经由 PCT 处理的8种临床肿瘤 FFPE 样本的蛋白鉴定结果中位数可达 7991。
目前,西湖欧米的微量样本蛋白质组学服务项目仅需 2 张 FFPE 切片样本(规格:5 mm* 5 mm大小,5μm 厚),对于活检穿刺样本,2 针即可,极大地节约了临床样本用量。
基于 FFPE 样本的蛋白质组学合作案例
2020年,正值新冠疫情严峻时刻,COVID-19 患者多器官损伤的分子病理学尚不清楚,研究通过对 7 种不同器官的FFPE样本进行分析,描绘了 COVID-19 尸检的多器官蛋白质组学景观,发现 COVID-19 患者的肺部组织蛋白酶 L1 明显上调,且在多个器官中检测到全身性高炎症和葡萄糖以及脂肪酸代谢失调。该研究进一步加深了我们对新冠肺炎病理学生物学基础的理解[4]。
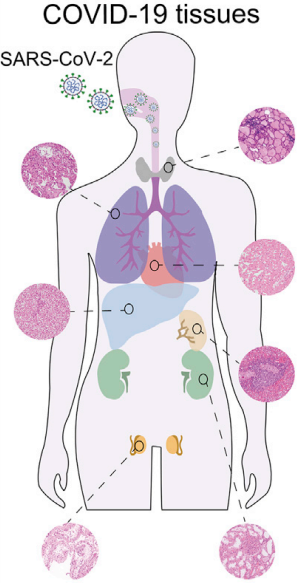
Cell发布: 7 种不同器官的 FFPE 样本探索新冠感染后的蛋白质组变化
2022年9月6日,大队列甲状腺结节良恶性评估文章上线 Cell Discovery[5],西湖欧米联合国内外多个团队共同合作,对 1724 个甲状腺结节的石蜡样本进行分析,通过 PCT-DIA 方法采集其蛋白质组学定量表达数据,自主研发人工智能神经网络模型,从中筛选出 19 个特征性蛋白质分子,用以判别甲状腺结节的良恶性。
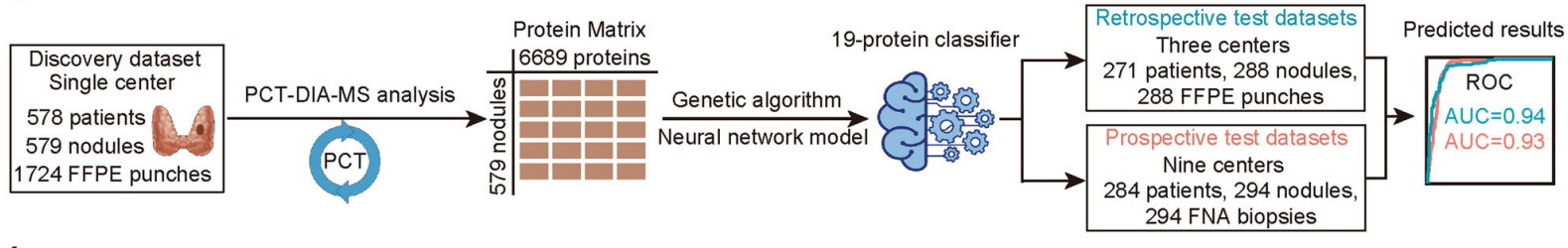
从 1724 例 FFPE Punch 样本中构建人工智能模型,攻克临床难题
FFPE 的“层次记忆”探索
实现 FFPE 样本的微量蛋白组开发后,西湖欧米团队又将目光投向“空间维度”上的 FFPE,开始探索 FFPE 样本中的“层次记忆”。我们通过将样本放大,探索不同区域部位的空间差异。
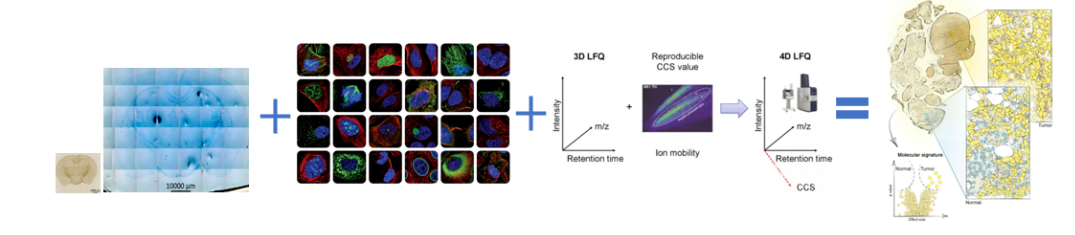
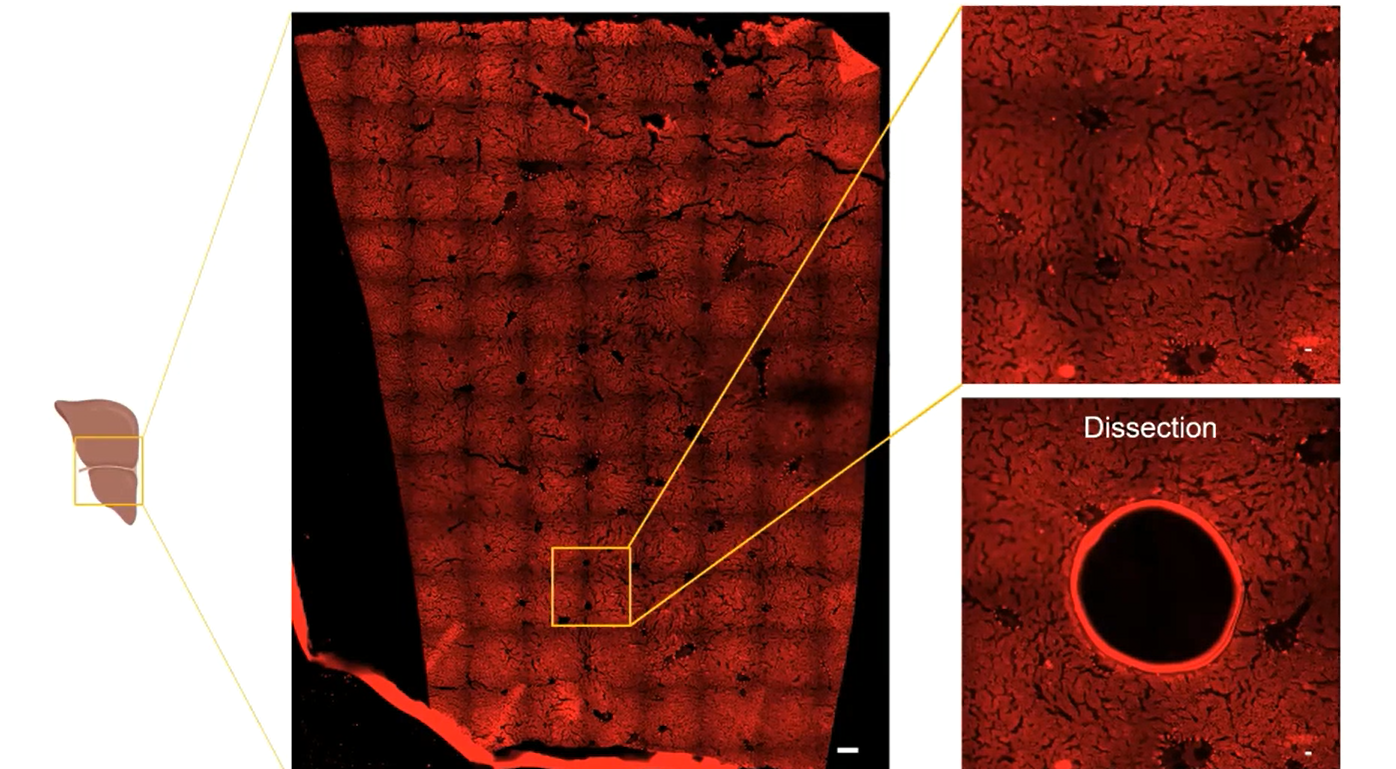
西湖欧米新品:可“膨胀”的空间蛋白质组学
空间蛋白技术详解:空间蛋白组学 | 搭乘驶向新风口的快车
FFPE 样本经膨胀后的又一研究形态,精准空间位置的蛋白组研究
FFPE 样本在医院的存储资源大,是较好的回顾性研究材料。我们可以期待,从一张小小的切片窥见蛋白质数据的惊喜变化,助力精准医疗的进化与发展。
“Tonight, I’m launching a new Precision Medicine Initiative to bring us closer to curing diseases like cancer and diabetes — and to give all of us access to the personalized information we need to keep ourselves and our families healthier.”
2015年精准医疗被提出[6] 期待现在,展望未来。
编译:江燕
审校:刘晶晶
参考文献:
1. Coscia F, Doll S, Bech JM, Schweizer L, Mund A, Lengyel E, Lindebjerg J, Madsen GI, Moreira JM, Mann M. A streamlined mass spectrometry-based proteomics workflow for large-scale FFPE tissue analysis. J Pathol. 2020 May;251(1):100-112.
2. Guo T, Kouvonen P, Koh CC, Gillet LC, Wolski WE, Röst HL, Rosenberger G, Collins BC, Blum LC, Gillessen S, Joerger M, Jochum W, Aebersold R. Rapid mass spectrometric conversion of tissue biopsy samples into permanent quantitative digital proteome maps. Nat Med. 2015 Apr;21(4):407-13.
3. Cai X, Xue Z, Wu C, Sun R, Qian L, Yue L, Ge W, Yi X, Liu W, Chen C, Gao H, Yu J, Xu L, Zhu Y, Guo T. High-throughput proteomic sample preparation using pressure cycling technology. Nat Protoc. 2022 Oct;17(10):2307-2325.
4. Nie X, Qian L, Sun R, et al. Multi-organ proteomic landscape of COVID-19 autopsies. Cell. 2021 Feb 4;184(3):775-791.e14.
5. Sun Y, Selvarajan S, Zang Z, et al. Artificial intelligence defines protein-based classification of thyroid nodules. Cell Discov. 2022 Sep 6;8(1):85.
6. Collins FS, Varmus H. A new initiative on precision medicine. N Engl J Med. 2015; 372(9):793-5.

人的记忆会随着时间的进展以及年龄的老去逐渐模糊,通常我们会采用影像及文字等形式留存住值得纪念的片刻时光。
在疾病的研究中,为了探索更针对性的个性化治疗方案,疾病进展期间和治疗期间的“记忆”如何被保存下来?一代又一代的科研工作者们又如何破解开这些“记忆”的密码,这是非常值得关注的问题。
医生们通常将手术切下来的样本制作成福尔马林固定石蜡包埋组织 FFPE(formalin-fixed paraffin-embedded),用于保存样本在不同时期的“记忆”,便于后续研究。FFPE 样本是生物医学研究珍贵的“记忆”库,蕴藏了非常多的有价值的信息。有研究表明 FFPE 样本中的蛋白质能够在数十年内保持稳定,非常适合做蛋白质组学(Proteomics)研究[1]。

珍贵的“记忆”库:FFPE样本

2015年,一篇关于结合 PCT 压力循环技术应用于蛋白质组学的文章发表在 Nature Medicine 上[2],西湖欧米创始人郭天南研究员独创的微量蛋白质组学方法得到学术界认可。自此,在蛋白质组学研究领域,PCT 技术开始高频地与“微量”概念绑定。
文章标题

PCT 技术是一种专门适用于微量样本的前处理技术,通过让FFPE组织样本接受“压力”,从而高效地破碎组织,提取蛋白。
基于PCT技术的微量样本蛋白质组学流程
PCT技术详解:欧米技术丨让蛋白质组感受压力:PCT 如何深度处理微量组织样本
近几年,郭天南团队不断对基于 PCT 的微量样本蛋白质组学方法进行优化,以期能够用更少的样本量鉴定到更多的蛋白质。2022年8月5日,此技术再次实现了升级。升级后的 PCT 前处理方法能够实现低至 0.1mg 极微量组织,以及针对细胞、粪便、泪液试纸等样本的高通量蛋白质组分析,该方法非常适合 FFPE 石蜡样本和活检穿刺样本的临床大队列蛋白质组学研究[3]。

最新PCT微量样本蛋白质组方法学文章
西湖欧米 PCT 微量样本蛋白质组学优势
(1) 无缝体系:将组织裂解-蛋白质提取-酶解消化集成一体,尽可能减少因样本转移带来的损失。
(2) 极少样本量:最低可达 0.1 mg 组织分析。
(3) 高重现性:每个步骤精确控制,最大限度地减少技术误差,CV<20%。
(4) 高深度鉴定量:文章数据表明,经由 PCT 处理的8种临床肿瘤 FFPE 样本的蛋白鉴定结果中位数可达 7991。
目前,西湖欧米的微量样本蛋白质组学服务项目仅需 2 张 FFPE 切片样本(规格:5 mm* 5 mm大小,5μm 厚),对于活检穿刺样本,2 针即可,极大地节约了临床样本用量。
基于 FFPE 样本的蛋白质组学合作案例
2020年,正值新冠疫情严峻时刻,COVID-19 患者多器官损伤的分子病理学尚不清楚,研究通过对 7 种不同器官的FFPE样本进行分析,描绘了 COVID-19 尸检的多器官蛋白质组学景观,发现 COVID-19 患者的肺部组织蛋白酶 L1 明显上调,且在多个器官中检测到全身性高炎症和葡萄糖以及脂肪酸代谢失调。该研究进一步加深了我们对新冠肺炎病理学生物学基础的理解[4]。

Cell发布: 7 种不同器官的 FFPE 样本探索新冠感染后的蛋白质组变化
2022年9月6日,大队列甲状腺结节良恶性评估文章上线 Cell Discovery[5],西湖欧米联合国内外多个团队共同合作,对 1724 个甲状腺结节的石蜡样本进行分析,通过 PCT-DIA 方法采集其蛋白质组学定量表达数据,自主研发人工智能神经网络模型,从中筛选出 19 个特征性蛋白质分子,用以判别甲状腺结节的良恶性。

从 1724 例 FFPE Punch 样本中构建人工智能模型,攻克临床难题
FFPE 的“层次记忆”探索
实现 FFPE 样本的微量蛋白组开发后,西湖欧米团队又将目光投向“空间维度”上的 FFPE,开始探索 FFPE 样本中的“层次记忆”。我们通过将样本放大,探索不同区域部位的空间差异。


西湖欧米新品:可“膨胀”的空间蛋白质组学
空间蛋白技术详解:空间蛋白组学 | 搭乘驶向新风口的快车
FFPE 样本经膨胀后的又一研究形态,精准空间位置的蛋白组研究
FFPE 样本在医院的存储资源大,是较好的回顾性研究材料。我们可以期待,从一张小小的切片窥见蛋白质数据的惊喜变化,助力精准医疗的进化与发展。
“Tonight, I’m launching a new Precision Medicine Initiative to bring us closer to curing diseases like cancer and diabetes — and to give all of us access to the personalized information we need to keep ourselves and our families healthier.”
2015年精准医疗被提出[6] 期待现在,展望未来。
编译:江燕
审校:刘晶晶
参考文献:
1. Coscia F, Doll S, Bech JM, Schweizer L, Mund A, Lengyel E, Lindebjerg J, Madsen GI, Moreira JM, Mann M. A streamlined mass spectrometry-based proteomics workflow for large-scale FFPE tissue analysis. J Pathol. 2020 May;251(1):100-112.
2. Guo T, Kouvonen P, Koh CC, Gillet LC, Wolski WE, Röst HL, Rosenberger G, Collins BC, Blum LC, Gillessen S, Joerger M, Jochum W, Aebersold R. Rapid mass spectrometric conversion of tissue biopsy samples into permanent quantitative digital proteome maps. Nat Med. 2015 Apr;21(4):407-13.
3. Cai X, Xue Z, Wu C, Sun R, Qian L, Yue L, Ge W, Yi X, Liu W, Chen C, Gao H, Yu J, Xu L, Zhu Y, Guo T. High-throughput proteomic sample preparation using pressure cycling technology. Nat Protoc. 2022 Oct;17(10):2307-2325.
4. Nie X, Qian L, Sun R, et al. Multi-organ proteomic landscape of COVID-19 autopsies. Cell. 2021 Feb 4;184(3):775-791.e14.
5. Sun Y, Selvarajan S, Zang Z, et al. Artificial intelligence defines protein-based classification of thyroid nodules. Cell Discov. 2022 Sep 6;8(1):85.
6. Collins FS, Varmus H. A new initiative on precision medicine. N Engl J Med. 2015; 372(9):793-5.









