

图1 文章标题
♦ 实验样本及设计
研究队列和样本:透明细胞卵巢癌(CCOC,n=192),高级别浆液性卵巢癌(HGSC,n=34),子宫内膜样卵巢癌(ENOC,n=35),低级别浆液性癌症(LGSC,n=31) 组学方法:TMT蛋白质组学
♦ 文章结论
◊ 蛋白质组学将CCOC确定为与其他卵巢癌亚型相比的一种独特疾病
蛋白质组学分析鉴定了7468种蛋白质,其中3069种在所有样品中进行了定量。在主成分分析(PCA)中,与其他EOC亚型相比,CCOC显示出明显的蛋白组学景观。PCA还表明,尽管HGSC、LGSC和ENOC内部存在异质性,导致蛋白质组特征重叠,但它们的蛋白组学景观与CCOC不同。有趣的是,当使用整个EOC队列时,在分层聚类分析中将CCOC队列分为两个主要分支。进一步研究了导致蛋白质组差异的混杂因素,包括批次效应、生物库位置和肿瘤含量,其中肿瘤含量与CCOC病例的某些分离相关。差异丰度分析确定了临床CCOC标志物(NAPSA),先前鉴定的IHC CCOC标志物(CTH、LEFTY1),以及先前蛋白质和转录组分析中CCOC高表达的基因(PSAT1、ANXA4、GPX3、LAMC1和SOD2)。
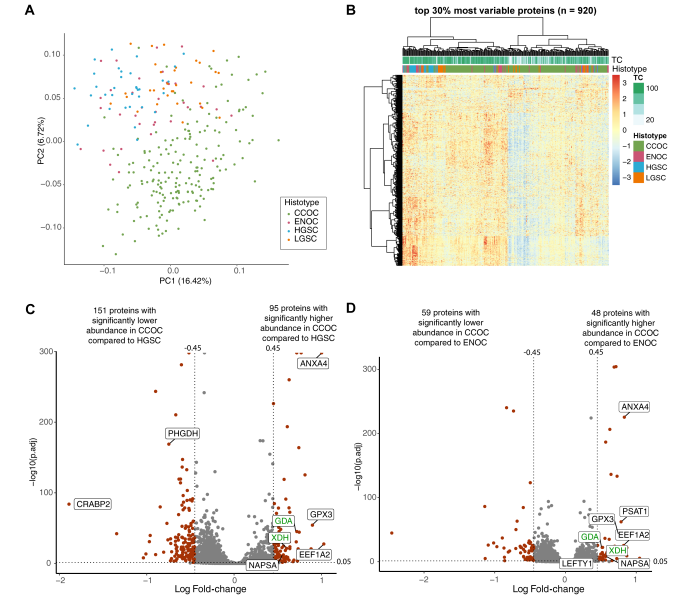
图2 CCOC具有独特的蛋白质组特征
与其他亚型相比,许多代谢酶在CCOC中具有更高的丰度,包括嘌呤代谢途径蛋白(XDH、GDA)和丝氨酸/半胱氨酸相关途径蛋白(PSAT1、CTH、GPX3)。层粘连蛋白亚基(LAMC1、LAMB1、LAMA4)在CCOC中含量很高。进一步进行了基因集富集分析(GSEA),以确定每种EOC亚型中富集的通路。与ENOC和HGSC相比,CCOC富含与稳态、细胞外基质和脂质代谢相关的过程。与CCOC相比,ENOC和HGSC中富集了类似的通路,包括蛋白质代谢和DNA复制的途径。
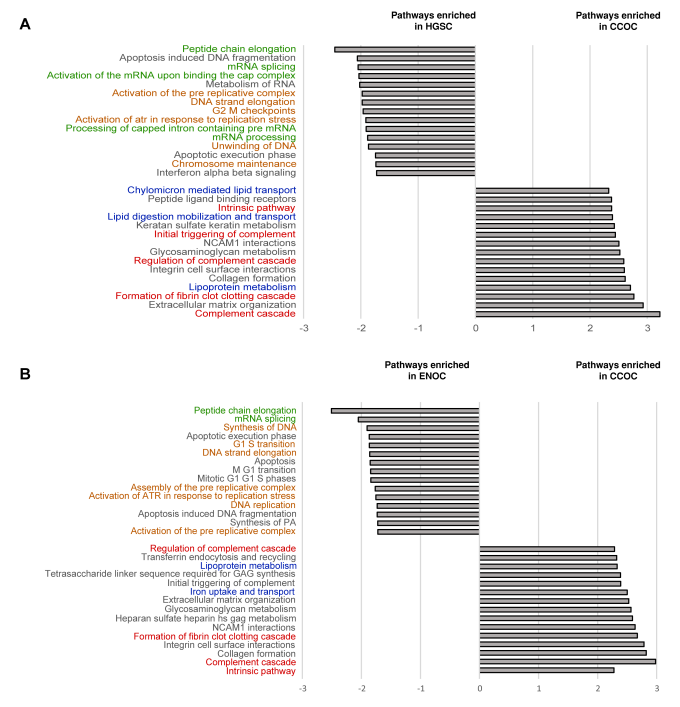
图3 将CCOC与ENOC和HGSC进行GSEA比较
◊ CCOC中存在不同的临床相关亚群
根据形态学和蛋白质组学特征,研究人员将CCOC分为4个亚群,分别定义为:代谢活性、凝血、纤维化和坏死。纤维化亚群富含基质纤维组织,而坏死亚群与其他亚群相比具有更多的肿瘤坏死。使用GSEA分析,纤维化亚群显示细胞外基质途径中蛋白质的富集,与纤维化区域的丰度一致。此外,坏死亚群显示凝血和血小板活化途径的富集,提示对坏死的急性炎症反应。相反,代谢活性亚群在蛋白质周转控制、细胞周期控制、三羧酸循环、电子传递链、氨基酸和脂肪酸代谢过程中富集。尽管形态上没有明显的坏死,但凝血亚群在脂蛋白转运和分解,以及补体激活和凝血途径中富集。
由于代谢和凝血亚群的结果最明显,受纤维化和坏死组织的影响最小,研究人员对这两个亚群进行了差异蛋白表达分析。结果发现,与代谢亚群相比,凝血亚群中的炎症过程和纤维蛋白原亚基显著累积。此外,纤维蛋白原亚基的表达与凝血亚群中坏死组织的数量无关。虽然纤维化和坏死亚群具有相似的分期分布,但代谢亚群包含更多的1期和2期患者。相比之下,凝血亚群在3期和4期患者中的比例最高。生存分析显示,两个亚群之间的OS无显著差异,但凝血亚群的PFS明显较差。单变量分析表明,代谢亚群与更好的PFS相关,但与OS无关,而凝血亚群的PFS明显更差。在调整年龄、级别、分期、残留疾病、ARID1A IHC和辅助治疗的多变量生存分析中,代谢亚群与OS和PFS显著改善相关,而凝血亚群预测结果更差。
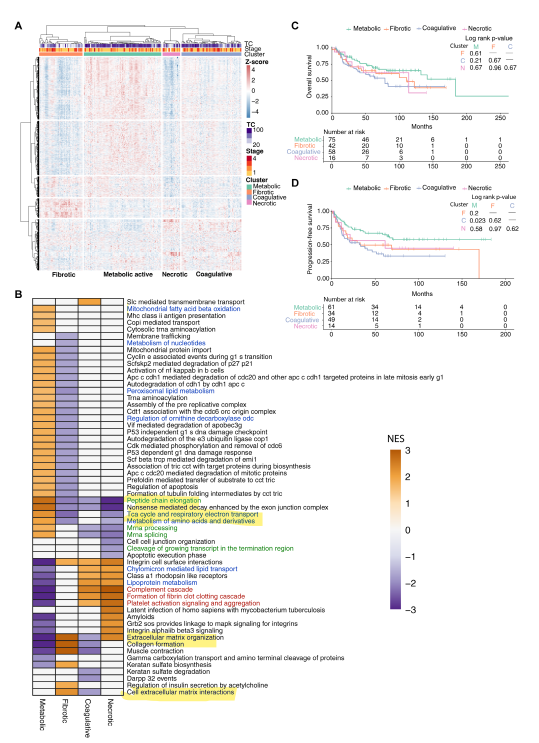
图4 CCOC存在不同的临床相关亚群
◊ 使用免疫组化进行靶向验证
与其他亚型相比,参与嘌呤代谢的多种酶在CCOC中的丰度更高,包括鸟嘌呤脱氨酶(GDA)和黄嘌呤脱氨酸酶(XDH)。GDA和XDH是参与鸟嘌呤顺序分解为尿酸的酶,表明这一途径存在异常。研究人员使用蛋白质组筛选队列和来自当地的独立验证队列的组合来验证蛋白质组研究结果。GDA在CCOC和ENOC中表现出肿瘤特异性细胞质染色,在HGSC中为零。IHC分析证实了这一发现,与ENOC和HGSC相比,CCOC具有最高的中位组织评分。验证队列GDA的IHC数据具有相似的结果。
有趣的是,CCOC中GDA的高表达与更好的疾病特异性生存率相关,但总体生存率或无进展生存率没有差异。这种生存优势也反映在蛋白质组学结果中。多变量生存分析显示,疾病特异性生存率显著提高。以上结果表明,通过GDA表达增加来激活嘌呤代谢是CCOC中比ENOC和HGSC中更常见的特征。
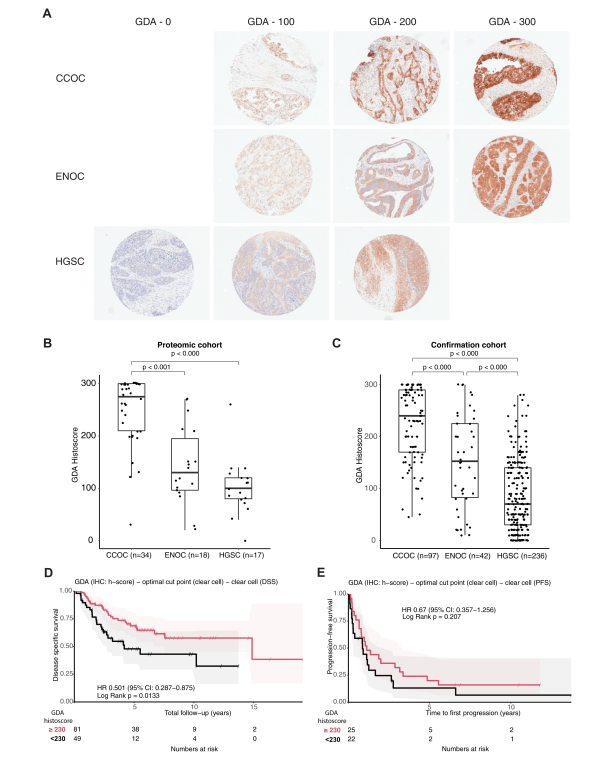
图5 鸟嘌呤脱氨酶 (GDA) 免疫组织化学验证



图1 文章标题
♦ 实验样本及设计
研究队列和样本:透明细胞卵巢癌(CCOC,n=192),高级别浆液性卵巢癌(HGSC,n=34),子宫内膜样卵巢癌(ENOC,n=35),低级别浆液性癌症(LGSC,n=31) 组学方法:TMT蛋白质组学
♦ 文章结论
◊ 蛋白质组学将CCOC确定为与其他卵巢癌亚型相比的一种独特疾病
蛋白质组学分析鉴定了7468种蛋白质,其中3069种在所有样品中进行了定量。在主成分分析(PCA)中,与其他EOC亚型相比,CCOC显示出明显的蛋白组学景观。PCA还表明,尽管HGSC、LGSC和ENOC内部存在异质性,导致蛋白质组特征重叠,但它们的蛋白组学景观与CCOC不同。有趣的是,当使用整个EOC队列时,在分层聚类分析中将CCOC队列分为两个主要分支。进一步研究了导致蛋白质组差异的混杂因素,包括批次效应、生物库位置和肿瘤含量,其中肿瘤含量与CCOC病例的某些分离相关。差异丰度分析确定了临床CCOC标志物(NAPSA),先前鉴定的IHC CCOC标志物(CTH、LEFTY1),以及先前蛋白质和转录组分析中CCOC高表达的基因(PSAT1、ANXA4、GPX3、LAMC1和SOD2)。

图2 CCOC具有独特的蛋白质组特征
与其他亚型相比,许多代谢酶在CCOC中具有更高的丰度,包括嘌呤代谢途径蛋白(XDH、GDA)和丝氨酸/半胱氨酸相关途径蛋白(PSAT1、CTH、GPX3)。层粘连蛋白亚基(LAMC1、LAMB1、LAMA4)在CCOC中含量很高。进一步进行了基因集富集分析(GSEA),以确定每种EOC亚型中富集的通路。与ENOC和HGSC相比,CCOC富含与稳态、细胞外基质和脂质代谢相关的过程。与CCOC相比,ENOC和HGSC中富集了类似的通路,包括蛋白质代谢和DNA复制的途径。

图3 将CCOC与ENOC和HGSC进行GSEA比较
◊ CCOC中存在不同的临床相关亚群
根据形态学和蛋白质组学特征,研究人员将CCOC分为4个亚群,分别定义为:代谢活性、凝血、纤维化和坏死。纤维化亚群富含基质纤维组织,而坏死亚群与其他亚群相比具有更多的肿瘤坏死。使用GSEA分析,纤维化亚群显示细胞外基质途径中蛋白质的富集,与纤维化区域的丰度一致。此外,坏死亚群显示凝血和血小板活化途径的富集,提示对坏死的急性炎症反应。相反,代谢活性亚群在蛋白质周转控制、细胞周期控制、三羧酸循环、电子传递链、氨基酸和脂肪酸代谢过程中富集。尽管形态上没有明显的坏死,但凝血亚群在脂蛋白转运和分解,以及补体激活和凝血途径中富集。
由于代谢和凝血亚群的结果最明显,受纤维化和坏死组织的影响最小,研究人员对这两个亚群进行了差异蛋白表达分析。结果发现,与代谢亚群相比,凝血亚群中的炎症过程和纤维蛋白原亚基显著累积。此外,纤维蛋白原亚基的表达与凝血亚群中坏死组织的数量无关。虽然纤维化和坏死亚群具有相似的分期分布,但代谢亚群包含更多的1期和2期患者。相比之下,凝血亚群在3期和4期患者中的比例最高。生存分析显示,两个亚群之间的OS无显著差异,但凝血亚群的PFS明显较差。单变量分析表明,代谢亚群与更好的PFS相关,但与OS无关,而凝血亚群的PFS明显更差。在调整年龄、级别、分期、残留疾病、ARID1A IHC和辅助治疗的多变量生存分析中,代谢亚群与OS和PFS显著改善相关,而凝血亚群预测结果更差。

图4 CCOC存在不同的临床相关亚群
◊ 使用免疫组化进行靶向验证
与其他亚型相比,参与嘌呤代谢的多种酶在CCOC中的丰度更高,包括鸟嘌呤脱氨酶(GDA)和黄嘌呤脱氨酸酶(XDH)。GDA和XDH是参与鸟嘌呤顺序分解为尿酸的酶,表明这一途径存在异常。研究人员使用蛋白质组筛选队列和来自当地的独立验证队列的组合来验证蛋白质组研究结果。GDA在CCOC和ENOC中表现出肿瘤特异性细胞质染色,在HGSC中为零。IHC分析证实了这一发现,与ENOC和HGSC相比,CCOC具有最高的中位组织评分。验证队列GDA的IHC数据具有相似的结果。
有趣的是,CCOC中GDA的高表达与更好的疾病特异性生存率相关,但总体生存率或无进展生存率没有差异。这种生存优势也反映在蛋白质组学结果中。多变量生存分析显示,疾病特异性生存率显著提高。以上结果表明,通过GDA表达增加来激活嘌呤代谢是CCOC中比ENOC和HGSC中更常见的特征。

图5 鸟嘌呤脱氨酶 (GDA) 免疫组织化学验证







