来源 | 动脉网
作者 | 胡琦玥
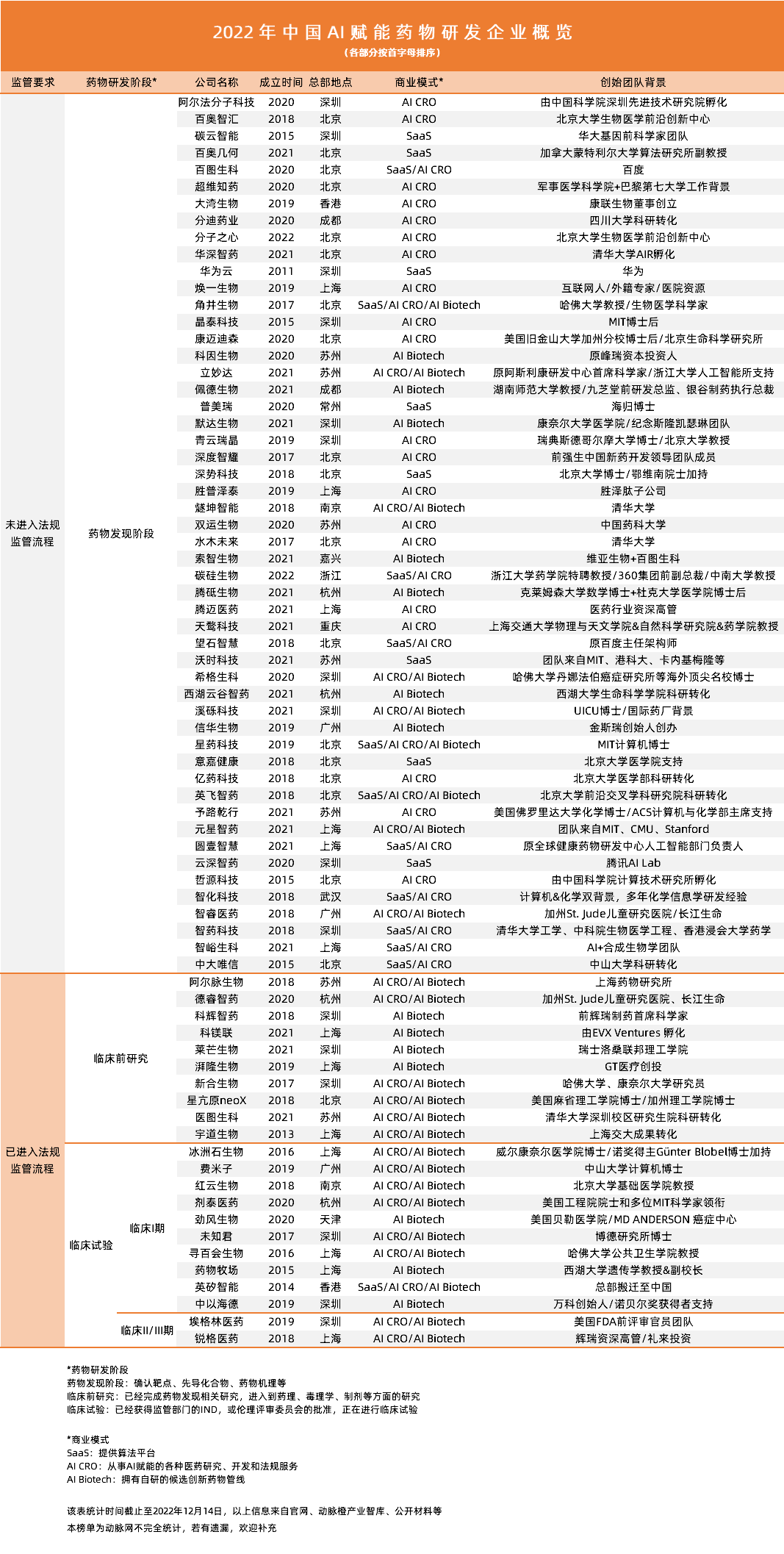
点击查看大图
♦ 从SaaS到AI CRO,再到AI Biotech,商业演化反应行业进化
♦ 药物发现阶段企业占70%,仅有两家企业的自有候选药物进入中晚期临床试验
◊ 药物发现:SaaS、AI CRO企业主导,比算法、比交付
◊ 临床前研究:AI CRO、AI Biotech主导,比IND获批的成熟度、差异化
◊ 临床试验:AI Biotech主导,比合规、比进度、比临床试验成功率
中国医药工业已经被那种数十个,甚至上百个某种 First in Class 的候选药品的现象困扰已久,“候选冠军” 也会因为迟迟无法完成临床转化而面临失去意义的风险。
♦ AI应用场景向后延伸,加速进入监管流程是趋势也是必然
伴随AI技术的发展与渗透,凭借行业内对 “快速推进药物研发” 的坚定追求,我们已经到了可以期待AI药物上市的时候!

来源 | 动脉网
作者 | 胡琦玥

点击查看大图
♦ 从SaaS到AI CRO,再到AI Biotech,商业演化反应行业进化
♦ 药物发现阶段企业占70%,仅有两家企业的自有候选药物进入中晚期临床试验
◊ 药物发现:SaaS、AI CRO企业主导,比算法、比交付
◊ 临床前研究:AI CRO、AI Biotech主导,比IND获批的成熟度、差异化
◊ 临床试验:AI Biotech主导,比合规、比进度、比临床试验成功率
中国医药工业已经被那种数十个,甚至上百个某种 First in Class 的候选药品的现象困扰已久,“候选冠军” 也会因为迟迟无法完成临床转化而面临失去意义的风险。
♦ AI应用场景向后延伸,加速进入监管流程是趋势也是必然
伴随AI技术的发展与渗透,凭借行业内对 “快速推进药物研发” 的坚定追求,我们已经到了可以期待AI药物上市的时候!