作者 | 王德振
自2019年12月新冠疫情暴发,到2023年1月8日新冠感染被降为 “乙类乙管”,已是三年有余。
作为一家AI驱动的蛋白组学研究型公司,西湖欧米从2020年成立开始就同合作者一道,参与到了新冠的相关研究中:利用蛋白组学、多组学以及AI致力于新冠的早期诊断、病程监督、预后监测和治疗等方面的研究,先后在Cell [1]、Cell Reports [2]、Cell Discovery [3,4]和Cell Reports Medicine [5] 等期刊上发表重要研究成果。
这里,我们基于已经发表的相关研究成果,从蛋白组学的层面来解释大家比较疑惑或者关心的一些问题。
比如:Omicron为什么引起了比较严重的发烧感冒症状?疫苗接种到底有没有效果,需不需要打加强针?自己有轻微或者中度症状,怎么知道自己会不会转变成重症?为什么 “阳康” 得有快有慢?哪些敏感人群需要特别注意保护?
♦ 发烧?咳嗽?咽喉痛?蛋白组学揭示Omicron的症状原因
在感染Omicron后,许多人都出现了发烧和咳嗽等症状,蛋白组的改变能很好地解释这一现象。
2022年,西湖欧米参与发表在 Cell Discovery 上的文章(图1)比较了Omicron毒株与其他毒株对血液蛋白组学的影响,结果发现Omicron引起了和其他毒株类似的蛋白组变化,主要体现在炎症相关通路的差异,包括补体系统、急性期反应和氧化应激反应等 [3](图2)。这些相似的炎症改变解释了为什么感染Omicron病毒后有大量人群出现了感冒发烧的症状。

图1
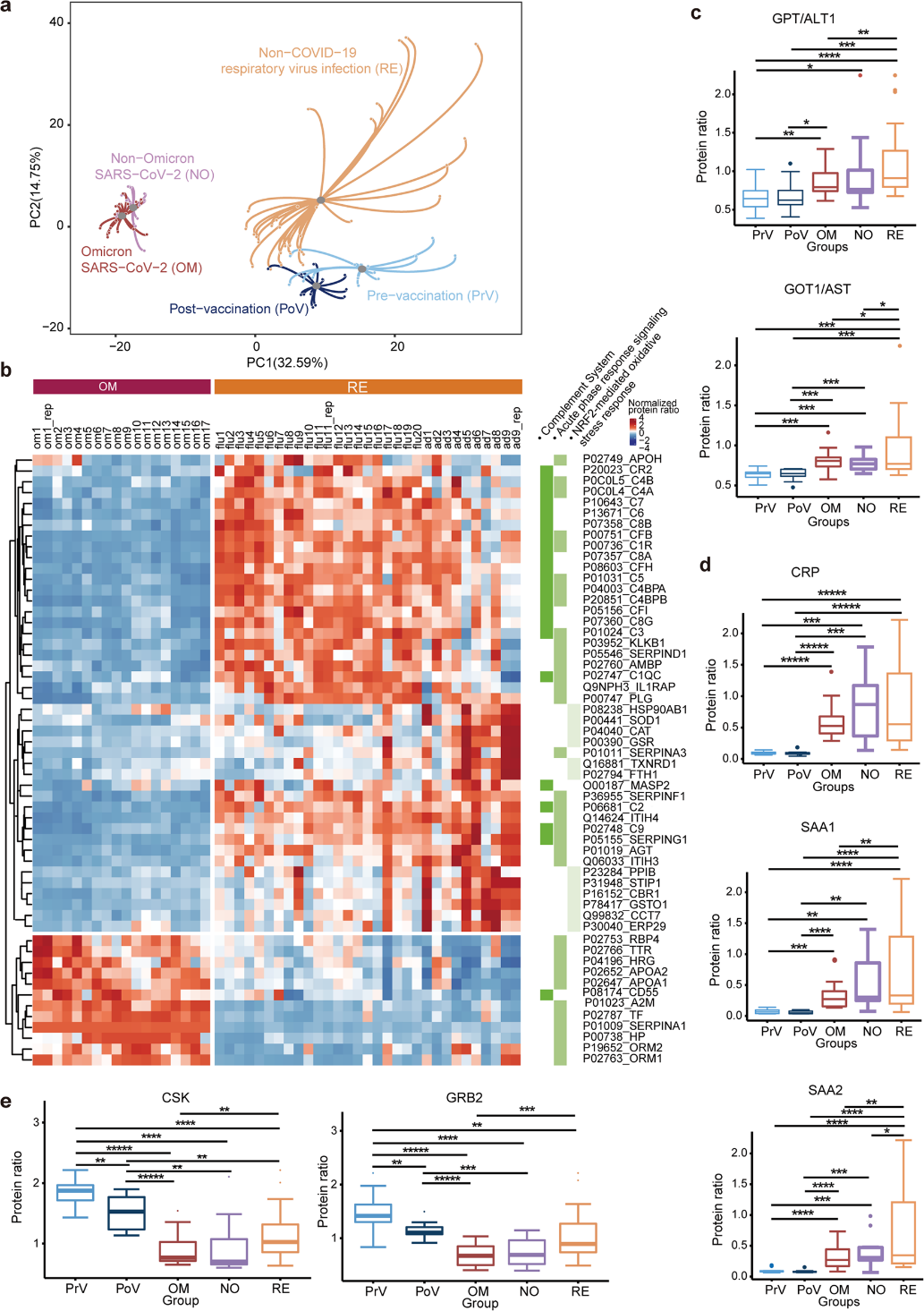
图2 Omicron和其他毒株以及非Omicron感染对血浆蛋白组的影响

图3
♦ 疫苗?加强针?蛋白组为疫苗的保护作用做注解
疫苗的接种虽然不能完全阻断新冠的感染和传播,但却能显著地降低重症率和死亡率。疫苗的这一保护作用在蛋白组层面上有所体现。
接种疫苗的健康人相比疫苗接种前有107个蛋白水平下降,而在感染Omicron后,这批蛋白水平有了进一步的下降。
这些蛋白主要与免疫途径相关,包括囊泡介导的运输、白细胞介导的免疫、补体的激活等。除了这107个蛋白外,剩下的406个蛋白也和这些免疫路径相关 [3](图4)。这些结果表明Omicron感染后会加强疫苗接种诱导的适应性免疫反应,体现了疫苗的保护作用。
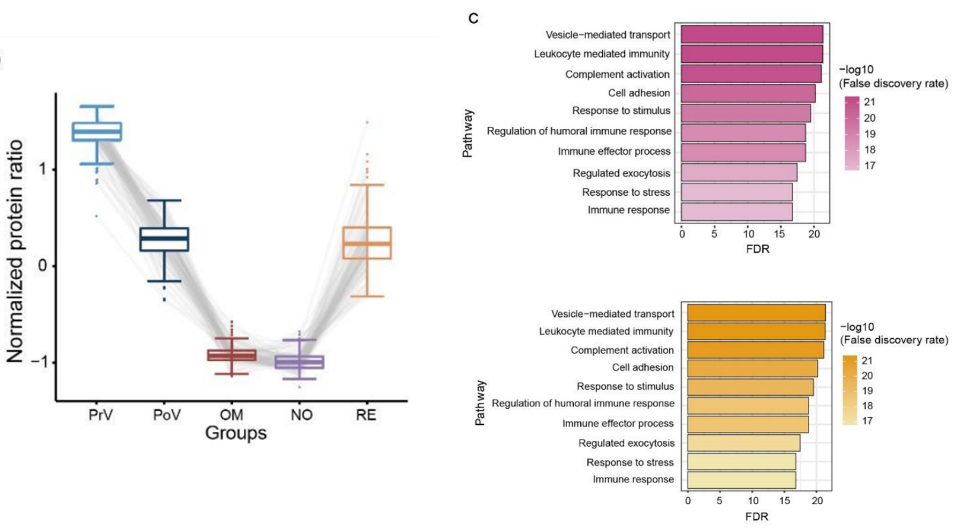
图4 疫苗接种对免疫相关的蛋白组的影响
但是,不同个体接种疫苗后抗体的产生和维持时间存在明显的差异,我们利用血清蛋白组、PBMC蛋白组结合AI模型,能够预测疫苗接种180天后的抗体的持久性 [6],这对于阐明免疫机制、合理计划疫苗加强针的接种十分重要。
♦ 轻症?重症?阳康?蛋白组为病程检测保驾护航
据现有数据显示,大部分新冠感染都是轻症或者中度症状,经过一到两周的自我健康管理后基本可以康复。但仍有小部分人群会出现比较严重的症状,需要在医院甚至重症监护室进行相应的治疗。
因此,对轻中症患者进行病程监测,防止其转化成重症,一方面可以挽救更多病人的生命,另外也可以防止医疗资源的过度挤兑。
我们和合作者2020年发表在Cell 的文章,比较了轻症和重症患者的血清蛋白组和代谢组的差异,结果发现,重症患者有93个蛋白和204个代谢物发生了显著程度的改变 [1]。
这些变化主要集中在巨噬细胞失调、血小板脱粒、补体途径和代谢抑制等。利用机器学习算法,我们发现了一组标志物的组合,能够很好地预测轻症和重症患者,这些标志物可以用作评价新冠严重程度的潜在指标[1](图5)。
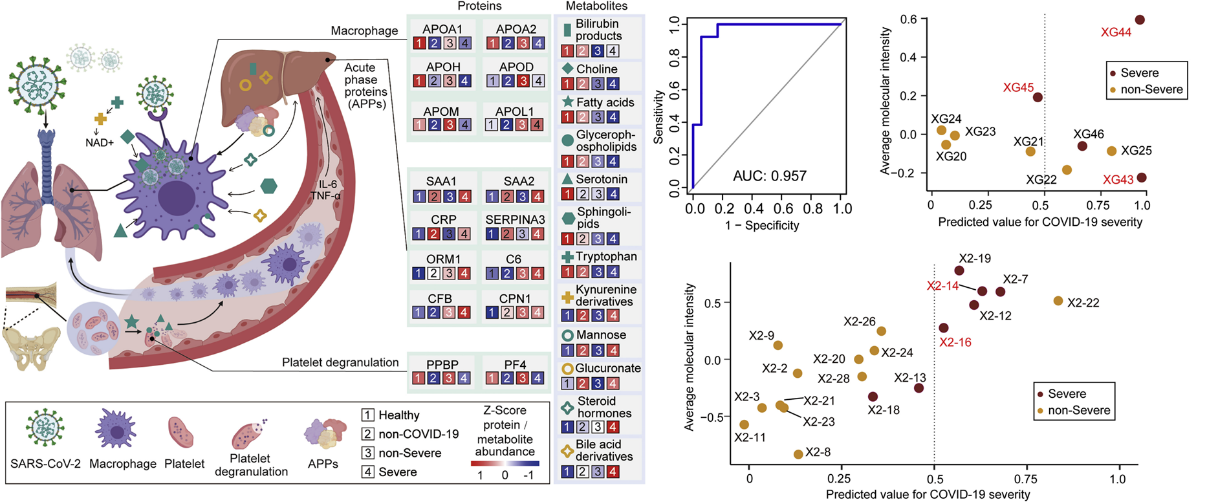
图5 重症与轻症的蛋白组差异
此外,不同个体在感染新冠后的康复进程也存在较大差异,有一部分感染人群存在 “长阳” 的现象。
2022年,我们参与发表在 Cell Discovery 上的文章,监测了 “长阳” 和 “短阳” 患者血清蛋白组和代谢组的动态变化过程(自发病起九周),揭示了长阳主要与LXR/RXR途径抑制、代谢抑制、补体系统激活、细胞迁移抑制和病毒复制增强等相关,简单来说主要是炎症增强和免疫抑制。与此同时,我们也利用机器学习算法,提出了多组学预测长病程的潜在标志物模型 [4](图6)。
感染新冠后的康复进程也与年龄密切相关,2021年发表在 EBioMedicine 上的一篇文章就显示,感染新冠14天后大部分人的蛋白组回归到了健康人的水平,但仍有一小部分人群的蛋白组与健康人存在较大差异,并且这些人群大部分都是老人,说明老人感染新冠后的恢复进程可能要更慢一些 [7]。
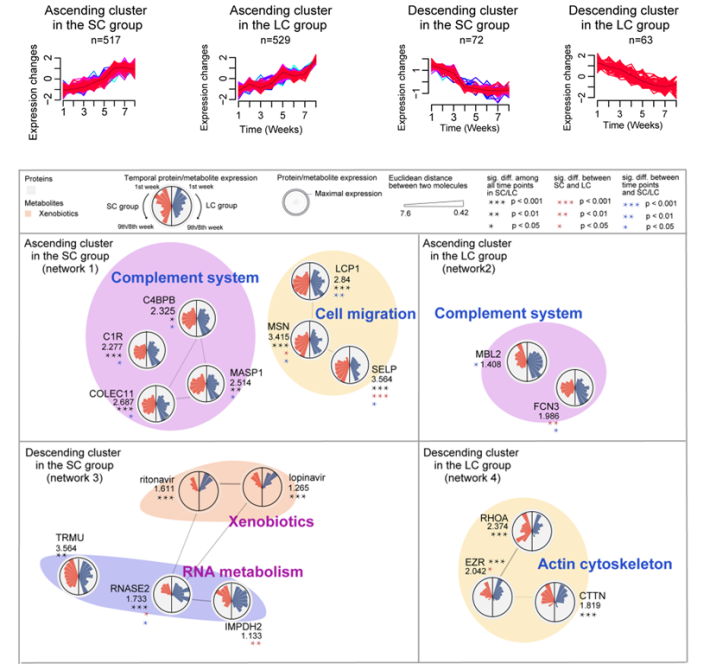
图6 长阳和短阳患者的蛋白组和代谢组差异
♦ 炎症?纤维化?血栓?蛋白组揭示新冠对脏器的损伤
2020年,我们参与发表在Cell 上的文章发现了重症患者的巨噬细胞失调、血小板脱粒、急性期反应等都与新冠最主要的细胞因子风暴和肺部损伤密切相关;与此同时,纤维蛋白原的累积和血小板脱粒反应也揭示了新冠患者发生血栓的风险在增加 [1]。
我们参与的多个研究也表明新冠感染会对肝脏造成损伤 [1,3]。2021年发表在 Signal Transduction and Targeted Therapy 上的一篇文章,揭示了血清中相关蛋白标志物的变化可以作为肝脏和肺功能损伤的重要指标 [8]。
2021年,我们参与发表在Cell 上的文章研究了感染新冠后多器官(肺、肝脏、肾脏、心脏、脾、睾丸、甲状腺)的蛋白组变化。我们发现在多个器官中均出现了缺氧、血管生成、凝血和纤维化等异常症状;还发现新冠感染造成了睾丸的损伤,像Leydig细胞减少、胆固醇生物合成受抑制和精子活动能力下降等 [9]。
2022年,我们参与发表在 Cell Reports 上的文章利用尿液蛋白组学揭示了免疫激活和炎症反应造成了肾脏的损伤,因此肾脏功能异常的人群需要格外注意 [2]。
♦ 小结
作为一家AI驱动的蛋白组微观大数据公司,西湖欧米一直致力于以蛋白质组大数据技术创新为驱动力,联合多模态大数据,助力精准医学和药物研发。
在过去三年里,我们充分利用自己在质谱和蛋白组学上的优势和经验,和医院以及高校合作,在新冠的早期诊断、病程监督、机理研究等方面都做出了重要的成绩。本文中介绍的文章1-5西湖欧米均为共同第一作者或者通讯作者。
未来,全球仍面临着流行病学和公共卫生方面的各种挑战,而不断更新的科学研究能为人类的健康管理提供更多的科学依据。
参考资料:
[1] Shen, B., Yi, X., Sun, Y., Bi, X., Du, J., Zhang, C., ... & Guo, T. (2020). Proteomic and metabolomic characterization of COVID-19 patient sera. Cell, 182(1), 59-72.
[2] Bi, X., Liu, W., Ding, X., Liang, S., Zheng, Y., Zhu, X., ... & Guo, T. (2022). Proteomic and metabolomic profiling of urine uncovers immune responses in patients with COVID-19. Cell reports, 38(3), 110271.
[3] Bao, J., Sun, R., Ai, J., Qian, L., Liu, F., Wang, H., ... & Guo, T. (2022). Proteomic characterization of Omicron SARS-CoV-2 host response. Cell discovery, 8(1), 1-4.
[4] Tang, X., Sun, R., Ge, W., Mao, T., Qian, L., Huang, C., ... & Guo, T. (2022). Enhanced inflammation and suppressed adaptive immunity in COVID-19 with prolonged RNA shedding. Cell Discovery, 8(1), 1-18.
[5] Lu, T., Wang, Y., & Guo, T. (2022). Multi-omics in COVID-19: Seeing the unseen but overlooked in the clinic. Cell Reports Medicine, 3(3), 100580.
[6] Wang, Y., Zhu, Q., Sun, R., Yi, X., Huang, L., Hu, Y., ... & Shi, J. (2022). Longitudinal proteomic investigation of COVID-19 vaccination. medRxiv.
[7] Zhong, W., Altay, O., Arif, M., Edfors, F., Doganay, L., Mardinoglu, A., ... & Fagerberg, L. (2021). Next generation plasma proteome profiling of COVID-19 patients with mild to moderate symptoms. EBioMedicine, 74, 103723.
[8] Leng, L., Li, M., Li, W., Mou, D., Liu, G., Ma, J., ... & Zhong, W. (2021). Sera proteomic features of active and recovered COVID-19 patients: potential diagnostic and prognostic biomarkers. Signal transduction and targeted therapy, 6(1), 1-3.

作者 | 王德振
自2019年12月新冠疫情暴发,到2023年1月8日新冠感染被降为 “乙类乙管”,已是三年有余。
作为一家AI驱动的蛋白组学研究型公司,西湖欧米从2020年成立开始就同合作者一道,参与到了新冠的相关研究中:利用蛋白组学、多组学以及AI致力于新冠的早期诊断、病程监督、预后监测和治疗等方面的研究,先后在Cell [1]、Cell Reports [2]、Cell Discovery [3,4]和Cell Reports Medicine [5] 等期刊上发表重要研究成果。
这里,我们基于已经发表的相关研究成果,从蛋白组学的层面来解释大家比较疑惑或者关心的一些问题。
比如:Omicron为什么引起了比较严重的发烧感冒症状?疫苗接种到底有没有效果,需不需要打加强针?自己有轻微或者中度症状,怎么知道自己会不会转变成重症?为什么 “阳康” 得有快有慢?哪些敏感人群需要特别注意保护?
♦ 发烧?咳嗽?咽喉痛?蛋白组学揭示Omicron的症状原因
在感染Omicron后,许多人都出现了发烧和咳嗽等症状,蛋白组的改变能很好地解释这一现象。
2022年,西湖欧米参与发表在 Cell Discovery 上的文章(图1)比较了Omicron毒株与其他毒株对血液蛋白组学的影响,结果发现Omicron引起了和其他毒株类似的蛋白组变化,主要体现在炎症相关通路的差异,包括补体系统、急性期反应和氧化应激反应等 [3](图2)。这些相似的炎症改变解释了为什么感染Omicron病毒后有大量人群出现了感冒发烧的症状。

图1

图2 Omicron和其他毒株以及非Omicron感染对血浆蛋白组的影响

图3
♦ 疫苗?加强针?蛋白组为疫苗的保护作用做注解
疫苗的接种虽然不能完全阻断新冠的感染和传播,但却能显著地降低重症率和死亡率。疫苗的这一保护作用在蛋白组层面上有所体现。
接种疫苗的健康人相比疫苗接种前有107个蛋白水平下降,而在感染Omicron后,这批蛋白水平有了进一步的下降。
这些蛋白主要与免疫途径相关,包括囊泡介导的运输、白细胞介导的免疫、补体的激活等。除了这107个蛋白外,剩下的406个蛋白也和这些免疫路径相关 [3](图4)。这些结果表明Omicron感染后会加强疫苗接种诱导的适应性免疫反应,体现了疫苗的保护作用。

图4 疫苗接种对免疫相关的蛋白组的影响
但是,不同个体接种疫苗后抗体的产生和维持时间存在明显的差异,我们利用血清蛋白组、PBMC蛋白组结合AI模型,能够预测疫苗接种180天后的抗体的持久性 [6],这对于阐明免疫机制、合理计划疫苗加强针的接种十分重要。
♦ 轻症?重症?阳康?蛋白组为病程检测保驾护航
据现有数据显示,大部分新冠感染都是轻症或者中度症状,经过一到两周的自我健康管理后基本可以康复。但仍有小部分人群会出现比较严重的症状,需要在医院甚至重症监护室进行相应的治疗。
因此,对轻中症患者进行病程监测,防止其转化成重症,一方面可以挽救更多病人的生命,另外也可以防止医疗资源的过度挤兑。
我们和合作者2020年发表在Cell 的文章,比较了轻症和重症患者的血清蛋白组和代谢组的差异,结果发现,重症患者有93个蛋白和204个代谢物发生了显著程度的改变 [1]。
这些变化主要集中在巨噬细胞失调、血小板脱粒、补体途径和代谢抑制等。利用机器学习算法,我们发现了一组标志物的组合,能够很好地预测轻症和重症患者,这些标志物可以用作评价新冠严重程度的潜在指标[1](图5)。

图5 重症与轻症的蛋白组差异
此外,不同个体在感染新冠后的康复进程也存在较大差异,有一部分感染人群存在 “长阳” 的现象。
2022年,我们参与发表在 Cell Discovery 上的文章,监测了 “长阳” 和 “短阳” 患者血清蛋白组和代谢组的动态变化过程(自发病起九周),揭示了长阳主要与LXR/RXR途径抑制、代谢抑制、补体系统激活、细胞迁移抑制和病毒复制增强等相关,简单来说主要是炎症增强和免疫抑制。与此同时,我们也利用机器学习算法,提出了多组学预测长病程的潜在标志物模型 [4](图6)。
感染新冠后的康复进程也与年龄密切相关,2021年发表在 EBioMedicine 上的一篇文章就显示,感染新冠14天后大部分人的蛋白组回归到了健康人的水平,但仍有一小部分人群的蛋白组与健康人存在较大差异,并且这些人群大部分都是老人,说明老人感染新冠后的恢复进程可能要更慢一些 [7]。

图6 长阳和短阳患者的蛋白组和代谢组差异
♦ 炎症?纤维化?血栓?蛋白组揭示新冠对脏器的损伤
2020年,我们参与发表在Cell 上的文章发现了重症患者的巨噬细胞失调、血小板脱粒、急性期反应等都与新冠最主要的细胞因子风暴和肺部损伤密切相关;与此同时,纤维蛋白原的累积和血小板脱粒反应也揭示了新冠患者发生血栓的风险在增加 [1]。
我们参与的多个研究也表明新冠感染会对肝脏造成损伤 [1,3]。2021年发表在 Signal Transduction and Targeted Therapy 上的一篇文章,揭示了血清中相关蛋白标志物的变化可以作为肝脏和肺功能损伤的重要指标 [8]。
2021年,我们参与发表在Cell 上的文章研究了感染新冠后多器官(肺、肝脏、肾脏、心脏、脾、睾丸、甲状腺)的蛋白组变化。我们发现在多个器官中均出现了缺氧、血管生成、凝血和纤维化等异常症状;还发现新冠感染造成了睾丸的损伤,像Leydig细胞减少、胆固醇生物合成受抑制和精子活动能力下降等 [9]。
2022年,我们参与发表在 Cell Reports 上的文章利用尿液蛋白组学揭示了免疫激活和炎症反应造成了肾脏的损伤,因此肾脏功能异常的人群需要格外注意 [2]。
♦ 小结
作为一家AI驱动的蛋白组微观大数据公司,西湖欧米一直致力于以蛋白质组大数据技术创新为驱动力,联合多模态大数据,助力精准医学和药物研发。
在过去三年里,我们充分利用自己在质谱和蛋白组学上的优势和经验,和医院以及高校合作,在新冠的早期诊断、病程监督、机理研究等方面都做出了重要的成绩。本文中介绍的文章1-5西湖欧米均为共同第一作者或者通讯作者。
未来,全球仍面临着流行病学和公共卫生方面的各种挑战,而不断更新的科学研究能为人类的健康管理提供更多的科学依据。
参考资料:
[1] Shen, B., Yi, X., Sun, Y., Bi, X., Du, J., Zhang, C., ... & Guo, T. (2020). Proteomic and metabolomic characterization of COVID-19 patient sera. Cell, 182(1), 59-72.
[2] Bi, X., Liu, W., Ding, X., Liang, S., Zheng, Y., Zhu, X., ... & Guo, T. (2022). Proteomic and metabolomic profiling of urine uncovers immune responses in patients with COVID-19. Cell reports, 38(3), 110271.
[3] Bao, J., Sun, R., Ai, J., Qian, L., Liu, F., Wang, H., ... & Guo, T. (2022). Proteomic characterization of Omicron SARS-CoV-2 host response. Cell discovery, 8(1), 1-4.
[4] Tang, X., Sun, R., Ge, W., Mao, T., Qian, L., Huang, C., ... & Guo, T. (2022). Enhanced inflammation and suppressed adaptive immunity in COVID-19 with prolonged RNA shedding. Cell Discovery, 8(1), 1-18.
[5] Lu, T., Wang, Y., & Guo, T. (2022). Multi-omics in COVID-19: Seeing the unseen but overlooked in the clinic. Cell Reports Medicine, 3(3), 100580.
[6] Wang, Y., Zhu, Q., Sun, R., Yi, X., Huang, L., Hu, Y., ... & Shi, J. (2022). Longitudinal proteomic investigation of COVID-19 vaccination. medRxiv.
[7] Zhong, W., Altay, O., Arif, M., Edfors, F., Doganay, L., Mardinoglu, A., ... & Fagerberg, L. (2021). Next generation plasma proteome profiling of COVID-19 patients with mild to moderate symptoms. EBioMedicine, 74, 103723.
[8] Leng, L., Li, M., Li, W., Mou, D., Liu, G., Ma, J., ... & Zhong, W. (2021). Sera proteomic features of active and recovered COVID-19 patients: potential diagnostic and prognostic biomarkers. Signal transduction and targeted therapy, 6(1), 1-3.