小分子调节剂通过多种机制影响其靶蛋白,从而发挥其潜在药物作用,了解它们的作用机制(MOA)有助于更好地进行分子挑选和治疗干预。在美国食品药品监督局(FDA)批准的药物中,大多数都靶向蛋白质,因此蛋白质水平的变化将提供最直接的化合物作用结果。
哈佛大学医学院生物细胞学系Steven P Gygi教授在Nature Biotechnology上发表了文章A proteome-wide atlas of drug mechanism of action。

在文章中,作者开发了一个基于96孔板的高通量筛选基础设施(图1),定量描述了875个化合物干扰下的全蛋白质图谱,解释了蛋白质组对化合物干预最敏感的部分。同时,作者使用蛋白质-蛋白质相关网络和化合物-化合物相关网络,揭示了肾上腺素受体拮抗剂JP1302的作用机制;作者还将化合物结构与作用机制联系起来,突出了该化合物库中化合物分子的非靶点多药理作用。将这些化合物进行全面分析后,作者还建立了一个相关网站,希望为未来的药物研发工作提供帮助。
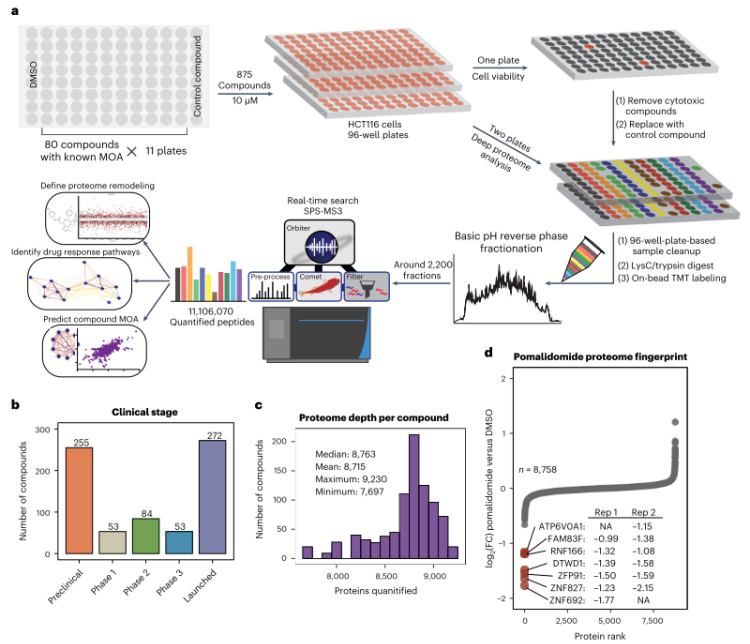
图1 基于96孔板的高通量筛选基础设施
在本研究中,作者首先选择由875个化合物小分子组成的筛选库,使用HCT116细胞作为实验材料,对化合物干扰后细胞蛋白质进行定量分析实验,对9860个观察到的蛋白质中的8863个进行了定量(图1c)。由于每个蛋白质组都编码了在每次化合物处理后产生的特定蛋白质水平变化,所以可以观察到一些药物的作用机制。如对于沙利度胺衍生的免疫调节药(IMiD)泊马松,直接观察到了其已知的作用机制,即通过与CRBN形成三元复合物降解多种蛋白质(图1d)。
为了研究小分子动态调控蛋白质的机制,作者定义了调控事件的两个标准:(1)与DMSO相比的二倍变化或(2)与所有化合物对该蛋白质的平均变化相比,蛋白质表达的五个标准差变化。从定量数据中可以得到,化合物诱导的蛋白质丰度变化在不同蛋白质间幅度不同,但同一类别的小分子诱导几乎相同的倍数变化幅度。
经过数据分析,作者发现上调的蛋白质富集了类固醇生物合成、细胞因子-细胞因子受体相互作用、线粒体自噬和铁死亡途径的成员;而下调的蛋白质富集了几个与细胞周期相关的途径中的蛋白质。这表明HCT116细胞通过上调自噬和类固醇代谢来克服外源性应激因子,通过细胞周期停滞来应对化合物诱导的应激。
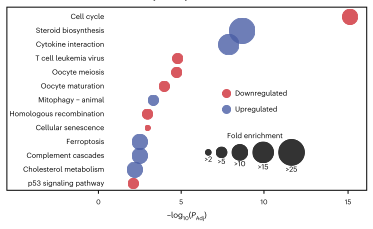
图2 蛋白质富集分析
那么靶蛋白是如何调节化合物MOA呢?除小分子诱导靶蛋白表达水平变化外,配体诱导的蛋白质表达变化也成为药物发现的研究热点。为此,作者鉴定了每种化合物的一个主要靶点和一个次要靶点,共得到了541个化合物-靶点对。
实验结果显示,在配体诱导的蛋白质表达变化中,经常可以观察到高活性化合物,这说明许多调节事件是扰乱重要细胞过程的间接后果,并不一定是直接由配体-靶点结合引起的。当不同的化合物针对同一种蛋白质时,通常会有相似的丰度变化,所以靶蛋白表达通常受到诱导广泛的蛋白质组水平变化的化合物调节。在这种调节机制之外,作者还发现一些靶蛋白受到了具有较窄蛋白质组水平影响的化合物的调节,这是特异性的配体诱导调节或局部反馈
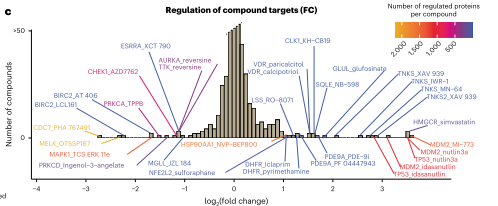
图3 靶蛋白表达水平直方图
为了得出进一步的结论,通过对所有可能的化合物对蛋白质组学干扰的指纹进行相关性分析,作者生成了一个具有MOA相似性网的化合物-化合物相关网络(图4)。
从这一网络中可以看到,一个群落将MDM2和CDK4/6抑制剂分组在一起,可能是因为这两类都会诱导G1停滞。由此可以确定互关联的化合物群落,包括具有重叠靶点的化合物,其关联反映了共享的生物学特征。
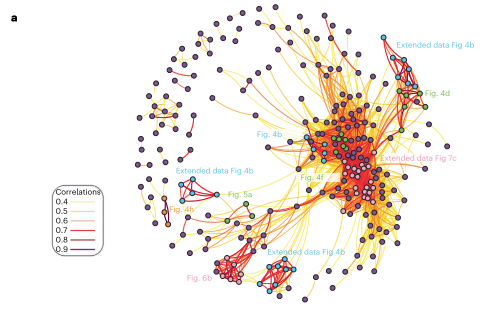
图4 化合物-化合物相关网络
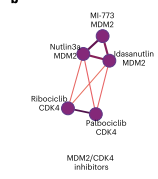
图5 MDM2和CDK4/6抑制剂子群落
通过”类推“,作者又生成了一个包含2,388个节点和35,936条边的蛋白质-蛋白质相互网络(图5)。
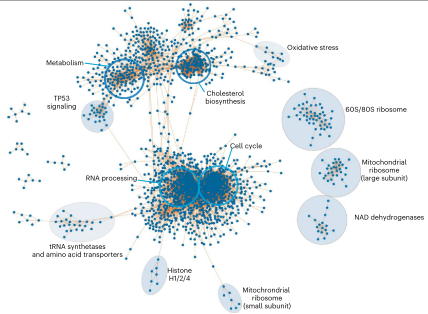
图5 蛋白质-蛋白质相关网络
网络显示,胆固醇生物合成蛋白质以及一些高度相关的自噬蛋白质被划分到同一群落中,表明细胞功能类似的蛋白质会被组成一些大的簇;20多种化合物驱动了若干个NDUF和丙酮酸脱氢酶(SDHA)蛋白的相关调节,解释了功能关联。
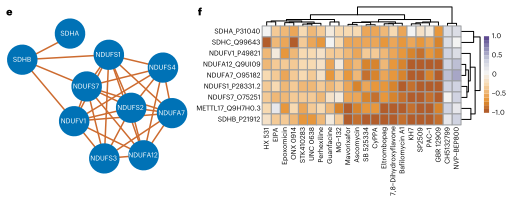
图6 相关蛋白亚群及每个蛋白表达的热图
为了测试这个数据集在MOA分离中的效用,作者选取了高活性化合物JP1302进行实验分析。通过化合物相关网络与蛋白质相关网络分析,结果显示,JP1302可以作为FACT抑制剂,抑制RNA转录,降低蛋白表达并分解组蛋白H1。
总的来说,通过对这一化学库进行全面分析,揭示了小分子化合物诱导蛋白质表达变化的机制,鉴定了调控HCT116细胞中超过9000种蛋白质表达的化合物,展示了化合物干扰反应中发生的蛋白质表达情况,为未来药物研发提供了帮助。
原文链接:https://www.nature.com/articles/s41587-022-01539-0
作者:于洁
审校:张程
小分子调节剂通过多种机制影响其靶蛋白,从而发挥其潜在药物作用,了解它们的作用机制(MOA)有助于更好地进行分子挑选和治疗干预。在美国食品药品监督局(FDA)批准的药物中,大多数都靶向蛋白质,因此蛋白质水平的变化将提供最直接的化合物作用结果。
哈佛大学医学院生物细胞学系Steven P Gygi教授在Nature Biotechnology上发表了文章A proteome-wide atlas of drug mechanism of action。

在文章中,作者开发了一个基于96孔板的高通量筛选基础设施(图1),定量描述了875个化合物干扰下的全蛋白质图谱,解释了蛋白质组对化合物干预最敏感的部分。同时,作者使用蛋白质-蛋白质相关网络和化合物-化合物相关网络,揭示了肾上腺素受体拮抗剂JP1302的作用机制;作者还将化合物结构与作用机制联系起来,突出了该化合物库中化合物分子的非靶点多药理作用。将这些化合物进行全面分析后,作者还建立了一个相关网站,希望为未来的药物研发工作提供帮助。

图1 基于96孔板的高通量筛选基础设施
在本研究中,作者首先选择由875个化合物小分子组成的筛选库,使用HCT116细胞作为实验材料,对化合物干扰后细胞蛋白质进行定量分析实验,对9860个观察到的蛋白质中的8863个进行了定量(图1c)。由于每个蛋白质组都编码了在每次化合物处理后产生的特定蛋白质水平变化,所以可以观察到一些药物的作用机制。如对于沙利度胺衍生的免疫调节药(IMiD)泊马松,直接观察到了其已知的作用机制,即通过与CRBN形成三元复合物降解多种蛋白质(图1d)。
为了研究小分子动态调控蛋白质的机制,作者定义了调控事件的两个标准:(1)与DMSO相比的二倍变化或(2)与所有化合物对该蛋白质的平均变化相比,蛋白质表达的五个标准差变化。从定量数据中可以得到,化合物诱导的蛋白质丰度变化在不同蛋白质间幅度不同,但同一类别的小分子诱导几乎相同的倍数变化幅度。
经过数据分析,作者发现上调的蛋白质富集了类固醇生物合成、细胞因子-细胞因子受体相互作用、线粒体自噬和铁死亡途径的成员;而下调的蛋白质富集了几个与细胞周期相关的途径中的蛋白质。这表明HCT116细胞通过上调自噬和类固醇代谢来克服外源性应激因子,通过细胞周期停滞来应对化合物诱导的应激。

图2 蛋白质富集分析
那么靶蛋白是如何调节化合物MOA呢?除小分子诱导靶蛋白表达水平变化外,配体诱导的蛋白质表达变化也成为药物发现的研究热点。为此,作者鉴定了每种化合物的一个主要靶点和一个次要靶点,共得到了541个化合物-靶点对。
实验结果显示,在配体诱导的蛋白质表达变化中,经常可以观察到高活性化合物,这说明许多调节事件是扰乱重要细胞过程的间接后果,并不一定是直接由配体-靶点结合引起的。当不同的化合物针对同一种蛋白质时,通常会有相似的丰度变化,所以靶蛋白表达通常受到诱导广泛的蛋白质组水平变化的化合物调节。在这种调节机制之外,作者还发现一些靶蛋白受到了具有较窄蛋白质组水平影响的化合物的调节,这是特异性的配体诱导调节或局部反馈

图3 靶蛋白表达水平直方图
为了得出进一步的结论,通过对所有可能的化合物对蛋白质组学干扰的指纹进行相关性分析,作者生成了一个具有MOA相似性网的化合物-化合物相关网络(图4)。
从这一网络中可以看到,一个群落将MDM2和CDK4/6抑制剂分组在一起,可能是因为这两类都会诱导G1停滞。由此可以确定互关联的化合物群落,包括具有重叠靶点的化合物,其关联反映了共享的生物学特征。

图4 化合物-化合物相关网络

图5 MDM2和CDK4/6抑制剂子群落
通过”类推“,作者又生成了一个包含2,388个节点和35,936条边的蛋白质-蛋白质相互网络(图5)。

图5 蛋白质-蛋白质相关网络
网络显示,胆固醇生物合成蛋白质以及一些高度相关的自噬蛋白质被划分到同一群落中,表明细胞功能类似的蛋白质会被组成一些大的簇;20多种化合物驱动了若干个NDUF和丙酮酸脱氢酶(SDHA)蛋白的相关调节,解释了功能关联。

图6 相关蛋白亚群及每个蛋白表达的热图
为了测试这个数据集在MOA分离中的效用,作者选取了高活性化合物JP1302进行实验分析。通过化合物相关网络与蛋白质相关网络分析,结果显示,JP1302可以作为FACT抑制剂,抑制RNA转录,降低蛋白表达并分解组蛋白H1。
总的来说,通过对这一化学库进行全面分析,揭示了小分子化合物诱导蛋白质表达变化的机制,鉴定了调控HCT116细胞中超过9000种蛋白质表达的化合物,展示了化合物干扰反应中发生的蛋白质表达情况,为未来药物研发提供了帮助。
原文链接:https://www.nature.com/articles/s41587-022-01539-0
作者:于洁
审校:张程









