才华横溢的歌手英年早逝,也让大家热议起这背后的疾病。
♦ 痣?还是癌?

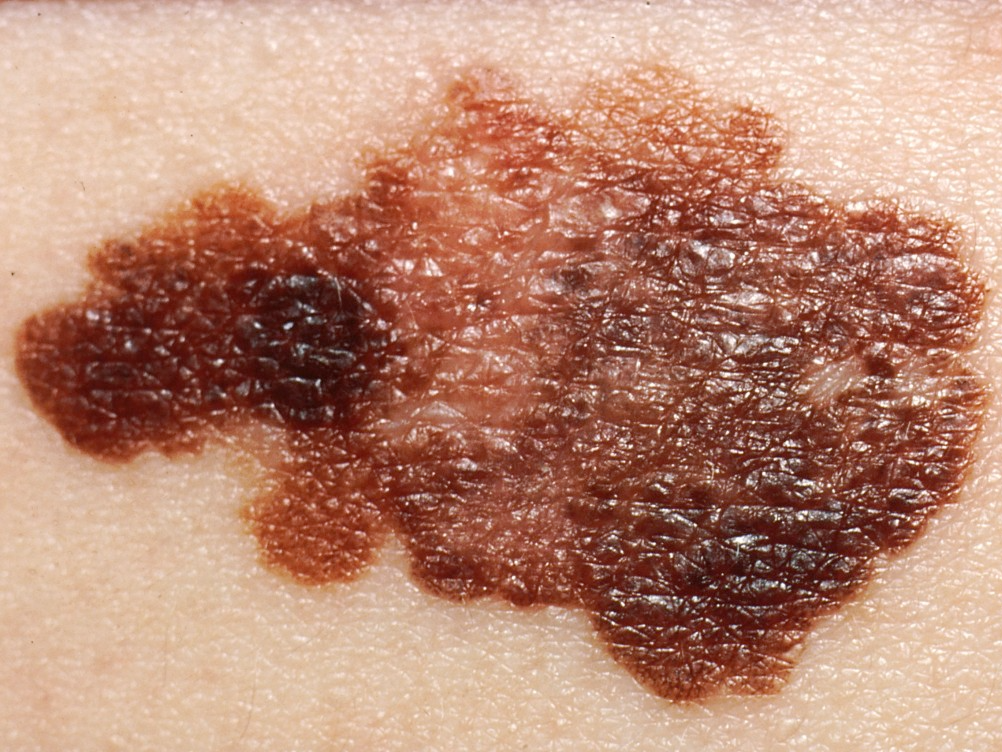
图源:wikipedia.org
左边是痣,而右边,则是黑色素瘤。
痣是皮肤或粘膜上的慢性斑块,是一种良性皮肤肿瘤。黑色素瘤,则是一种从黑色素细胞发展而来的恶性皮肤肿瘤。[1]
身体上的痣一般不需要治疗,但考虑到美观或病变可能性,可以通过手术切除。实际上,有25%的恶性黑色素瘤都是由已有的痣发展而来。[2]
皮肤黑色素瘤是全球第17位最常见的癌症 [3]。美国国家癌症研究所(National Cancer Institute, NCI)的统计数据显示,截至2020年,美国约有140万人患有黑色素瘤,且大约2.2%的人都会在一生中的某个时候被诊断出患有皮肤黑色素瘤。[4]
2020 年,Globocan(全球肿瘤流行病学数据库)报告了全球超32万的黑色素瘤新病例和近6万例的死亡病例。在许多欧洲国家,黑色素瘤正以3%至7%的速度增长,预计这一数字还会进一步上升。[5]
♦ 黑色素瘤,从而何来?
皮肤癌变的原因很多,饮食、营养和身体活动都可能诱发黑色素瘤。[3]
其中,暴露于紫外线辐射(如晒太阳或接触紫外线设备)是导致黑色素瘤的主要原因。紫外线辐射可以诱导与癌症特征一致的细胞变化,包括诱导基因组不稳定和突变、抵抗细胞死亡、激活持续的增殖信号和细胞生长,以及启动促进肿瘤的炎症反应。
总的来说,紫外线辐射对皮肤细胞有一系列影响,影响多种代谢途径,共同 “打造” 一个有利于癌症发生发展的细胞微环境,且这些影响可能受遗传因素的调节。

暴露于紫外线辐射是导致黑色素瘤的主要原因 图源:pixabay.com
因此,避免紫外线暴露以及有效防晒,可以预防黑色素瘤的产生。
此外,辐射、器官移植后抑制免疫系统的药物、人乳头瘤病毒感染、遗传和家族史以及皮肤色素沉着等因素,也与黑色素瘤风险增加有关。还有证据表明,引用被砷污染的水以及饮酒等行为,也会增加患皮肤癌的风险。
♦ 如何治疗黑色素瘤?
黑色素瘤通常的治疗方法是手术切除。若肿瘤没有转移,大部分病患可被治愈;对于肿瘤转移的病患,可以采用免疫疗法、放疗、化疗等方式来增加存活率。[1]
以美国的数据为例,患者接受治疗后,若只有局部病变,五年存活率可达98%;若发生转移,五年存活率只有17%左右。[4]
目前,只有一种经过临床验证的预测标记物(BRAF V600E)可用于分子靶向治疗。在一线治疗(靶向治疗与免疫检查点治疗)中,尚缺乏用于决定序贯给药的临床有用标志物。[6]
现有的科学技术,如基因组学、蛋白质组学、单细胞转录组学、机器学习等,已被开发用于识别黑色素瘤新的生物标志物,并将有助于建立临床预后。
♦ 蛋白质组学与黑色素瘤
人体内部的蛋白质处于动态运作之中,指示着当前生命体的健康状态和疾病进展情况,“隐藏” 着疾病的生物标志物和潜在的药物靶点。在黑色素瘤诊断和治疗的研究及肿瘤精准医学的发展之路上,蛋白质组学也正在持续发力。
例如,2019年,研究人员发现了一种特殊蛋白DDX3X,能调节与恶性黑色素瘤转移相关的基因的表达,该蛋白或可成为预测黑色素瘤恶性程度的潜在生物标志物。[7]
同年,Cell上的一篇研究采用高精度蛋白质组学方法,揭示了黑色素瘤代谢状态与免疫治疗反应之间的关联,这可能是未来改善治疗反应的基础。[8]
2020年,中国学者通过单细胞蛋白质组学和单细胞代谢组学研究,揭示了黑色素瘤细胞早期在药物反应和药物耐受两种状态之间的变化轨迹。[9]
2021年,来自瑞典隆德大学的研究人员绘制了恶性黑色素瘤中的蛋白质表达图谱。研究中的505个样本,来自200多名患者身体各个部位的黑色素瘤。通过质谱技术,研究人员鉴定出了15,500种蛋白质组(包括大量的细胞质蛋白和2,000种膜蛋白),并对原发性和转移性黑色素瘤的染色体和亚细胞定位进行了注释。
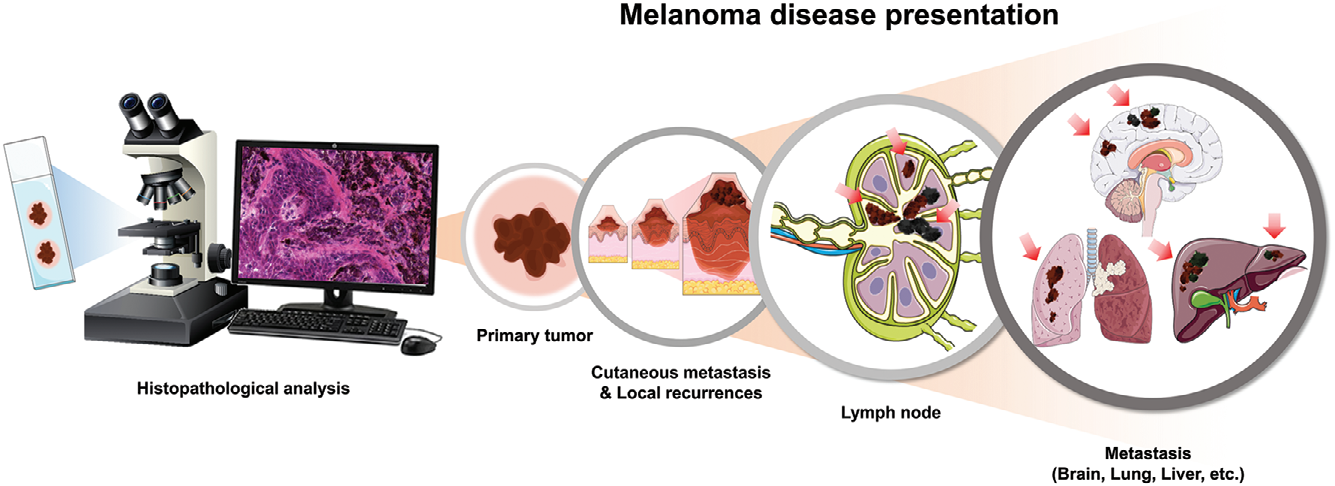
图源[10]
该研究发现,鉴定出的蛋白质中有很大一部分专门用于细胞分裂、剪接机制和新陈代谢,且线粒体功能在黑色素瘤中尤为重要。
这一突破性的黑色素瘤蛋白质表达图谱,涵盖了目前人类蛋白质组中72%的蛋白质。这些发现为转移性黑色素瘤的诊断、治疗、药物发现和药物开发奠定了基础,也为美国国立卫生研究院的癌症登月计划做出了重要贡献。[10]
临床上,恶性黑色素瘤在早期即可出现淋巴结、肝、肺、脑等处的转移,过程隐匿不易察觉。患者一旦出现转移,治疗就较为棘手,且预后较差。
在黑色素瘤的研究之路上,蛋白质组学算是后起之秀。近年来,蛋白质组学已广泛应用于黑色素瘤的研究,主要涉及生物标志物和转移相关标志物研究,为人类对抗黑色素瘤提供了许多新思路、新方法。
我们希望,在蛋白质组学等手段的助力下,现代医学能更好地诊断和治疗黑色素瘤。或许终有一天,抹掉损害人类生命健康的这颗 “致命黑痣”。
1.https://www.cancer.gov/types/skin/hp/melanoma-treatment-pdq
2.Sam, Amir H.; James TH Teo. Rapid Medicine . Wiley-Blackwell . 2010. ISBN 1405183233 .
3.https://www.wcrf.org/cancer-trends/skin-cancer-statistics/#:~:text=Latest%20skin%20cancer%20data,the%20reporting%20of%20cancer%20statistics.
4.https://seer.cancer.gov/statfacts/html/melan.html
5.https://gco.iarc.fr/
6.Burjanivova, Tatiana et al. “Detection of BRAFV600E Mutation in Melanoma Patients by Digital PCR of Circulating DNA.” Genetic testing and molecular biomarkers vol. 23,4 (2019): 241-245. doi:10.1089/gtmb.2018.0193
7.Phung, Bengt et al. “The X-Linked DDX3X RNA Helicase Dictates Translation Reprogramming and Metastasis in Melanoma.” Cell reports vol. 27,12 (2019): 3573-3586.e7. doi:10.1016/j.celrep.2019.05.069
1.Harel, Michal et al. “Proteomics of Melanoma Response to Immunotherapy Reveals Mitochondrial Dependence.” Cell vol. 179,1 (2019): 236-250.e18. doi:10.1016/j.cell.2019.08.012
8.Su, Yapeng et al. “Multi-omic single-cell snapshots reveal multiple independent trajectories to drug tolerance in a melanoma cell line.” Nature communications vol. 11,1 2345. 11 May. 2020, doi:10.1038/s41467-020-15956-9
9.Su, Yapeng et al. “Multi-omic single-cell snapshots reveal multiple independent trajectories to drug tolerance in a melanoma cell line.” Nature communications vol. 11,1 2345. 11 May. 2020, doi:10.1038/s41467-020-15956-9
10.Betancourt, Lazaro Hiram et al. “The human melanoma proteome atlas-Defining the molecular pathology.” Clinical and translational medicine vol. 11,7 (2021): e473. doi:10.1002/ctm2.473
才华横溢的歌手英年早逝,也让大家热议起这背后的疾病。
♦ 痣?还是癌?


图源:wikipedia.org
左边是痣,而右边,则是黑色素瘤。
痣是皮肤或粘膜上的慢性斑块,是一种良性皮肤肿瘤。黑色素瘤,则是一种从黑色素细胞发展而来的恶性皮肤肿瘤。[1]
身体上的痣一般不需要治疗,但考虑到美观或病变可能性,可以通过手术切除。实际上,有25%的恶性黑色素瘤都是由已有的痣发展而来。[2]
皮肤黑色素瘤是全球第17位最常见的癌症 [3]。美国国家癌症研究所(National Cancer Institute, NCI)的统计数据显示,截至2020年,美国约有140万人患有黑色素瘤,且大约2.2%的人都会在一生中的某个时候被诊断出患有皮肤黑色素瘤。[4]
2020 年,Globocan(全球肿瘤流行病学数据库)报告了全球超32万的黑色素瘤新病例和近6万例的死亡病例。在许多欧洲国家,黑色素瘤正以3%至7%的速度增长,预计这一数字还会进一步上升。[5]
♦ 黑色素瘤,从而何来?
皮肤癌变的原因很多,饮食、营养和身体活动都可能诱发黑色素瘤。[3]
其中,暴露于紫外线辐射(如晒太阳或接触紫外线设备)是导致黑色素瘤的主要原因。紫外线辐射可以诱导与癌症特征一致的细胞变化,包括诱导基因组不稳定和突变、抵抗细胞死亡、激活持续的增殖信号和细胞生长,以及启动促进肿瘤的炎症反应。
总的来说,紫外线辐射对皮肤细胞有一系列影响,影响多种代谢途径,共同 “打造” 一个有利于癌症发生发展的细胞微环境,且这些影响可能受遗传因素的调节。

暴露于紫外线辐射是导致黑色素瘤的主要原因 图源:pixabay.com
因此,避免紫外线暴露以及有效防晒,可以预防黑色素瘤的产生。
此外,辐射、器官移植后抑制免疫系统的药物、人乳头瘤病毒感染、遗传和家族史以及皮肤色素沉着等因素,也与黑色素瘤风险增加有关。还有证据表明,引用被砷污染的水以及饮酒等行为,也会增加患皮肤癌的风险。
♦ 如何治疗黑色素瘤?
黑色素瘤通常的治疗方法是手术切除。若肿瘤没有转移,大部分病患可被治愈;对于肿瘤转移的病患,可以采用免疫疗法、放疗、化疗等方式来增加存活率。[1]
以美国的数据为例,患者接受治疗后,若只有局部病变,五年存活率可达98%;若发生转移,五年存活率只有17%左右。[4]
目前,只有一种经过临床验证的预测标记物(BRAF V600E)可用于分子靶向治疗。在一线治疗(靶向治疗与免疫检查点治疗)中,尚缺乏用于决定序贯给药的临床有用标志物。[6]
现有的科学技术,如基因组学、蛋白质组学、单细胞转录组学、机器学习等,已被开发用于识别黑色素瘤新的生物标志物,并将有助于建立临床预后。
♦ 蛋白质组学与黑色素瘤
人体内部的蛋白质处于动态运作之中,指示着当前生命体的健康状态和疾病进展情况,“隐藏” 着疾病的生物标志物和潜在的药物靶点。在黑色素瘤诊断和治疗的研究及肿瘤精准医学的发展之路上,蛋白质组学也正在持续发力。
例如,2019年,研究人员发现了一种特殊蛋白DDX3X,能调节与恶性黑色素瘤转移相关的基因的表达,该蛋白或可成为预测黑色素瘤恶性程度的潜在生物标志物。[7]
同年,Cell上的一篇研究采用高精度蛋白质组学方法,揭示了黑色素瘤代谢状态与免疫治疗反应之间的关联,这可能是未来改善治疗反应的基础。[8]
2020年,中国学者通过单细胞蛋白质组学和单细胞代谢组学研究,揭示了黑色素瘤细胞早期在药物反应和药物耐受两种状态之间的变化轨迹。[9]
2021年,来自瑞典隆德大学的研究人员绘制了恶性黑色素瘤中的蛋白质表达图谱。研究中的505个样本,来自200多名患者身体各个部位的黑色素瘤。通过质谱技术,研究人员鉴定出了15,500种蛋白质组(包括大量的细胞质蛋白和2,000种膜蛋白),并对原发性和转移性黑色素瘤的染色体和亚细胞定位进行了注释。

图源[10]
该研究发现,鉴定出的蛋白质中有很大一部分专门用于细胞分裂、剪接机制和新陈代谢,且线粒体功能在黑色素瘤中尤为重要。
这一突破性的黑色素瘤蛋白质表达图谱,涵盖了目前人类蛋白质组中72%的蛋白质。这些发现为转移性黑色素瘤的诊断、治疗、药物发现和药物开发奠定了基础,也为美国国立卫生研究院的癌症登月计划做出了重要贡献。[10]
临床上,恶性黑色素瘤在早期即可出现淋巴结、肝、肺、脑等处的转移,过程隐匿不易察觉。患者一旦出现转移,治疗就较为棘手,且预后较差。
在黑色素瘤的研究之路上,蛋白质组学算是后起之秀。近年来,蛋白质组学已广泛应用于黑色素瘤的研究,主要涉及生物标志物和转移相关标志物研究,为人类对抗黑色素瘤提供了许多新思路、新方法。
我们希望,在蛋白质组学等手段的助力下,现代医学能更好地诊断和治疗黑色素瘤。或许终有一天,抹掉损害人类生命健康的这颗 “致命黑痣”。
1.https://www.cancer.gov/types/skin/hp/melanoma-treatment-pdq
2.Sam, Amir H.; James TH Teo. Rapid Medicine . Wiley-Blackwell . 2010. ISBN 1405183233 .
3.https://www.wcrf.org/cancer-trends/skin-cancer-statistics/#:~:text=Latest%20skin%20cancer%20data,the%20reporting%20of%20cancer%20statistics.
4.https://seer.cancer.gov/statfacts/html/melan.html
5.https://gco.iarc.fr/
6.Burjanivova, Tatiana et al. “Detection of BRAFV600E Mutation in Melanoma Patients by Digital PCR of Circulating DNA.” Genetic testing and molecular biomarkers vol. 23,4 (2019): 241-245. doi:10.1089/gtmb.2018.0193
7.Phung, Bengt et al. “The X-Linked DDX3X RNA Helicase Dictates Translation Reprogramming and Metastasis in Melanoma.” Cell reports vol. 27,12 (2019): 3573-3586.e7. doi:10.1016/j.celrep.2019.05.069
1.Harel, Michal et al. “Proteomics of Melanoma Response to Immunotherapy Reveals Mitochondrial Dependence.” Cell vol. 179,1 (2019): 236-250.e18. doi:10.1016/j.cell.2019.08.012
8.Su, Yapeng et al. “Multi-omic single-cell snapshots reveal multiple independent trajectories to drug tolerance in a melanoma cell line.” Nature communications vol. 11,1 2345. 11 May. 2020, doi:10.1038/s41467-020-15956-9
9.Su, Yapeng et al. “Multi-omic single-cell snapshots reveal multiple independent trajectories to drug tolerance in a melanoma cell line.” Nature communications vol. 11,1 2345. 11 May. 2020, doi:10.1038/s41467-020-15956-9
10.Betancourt, Lazaro Hiram et al. “The human melanoma proteome atlas-Defining the molecular pathology.” Clinical and translational medicine vol. 11,7 (2021): e473. doi:10.1002/ctm2.473