研究背景及简介
前列腺癌是男性发病率第三高的癌症,在全球范围内的癌症相关死亡中排名第五。目前的治疗决策算法主要依赖于根据肿瘤分期、诊断时的前列腺特异性抗原(Prostate specific antigen,PSA)水平和Gleason分级组(GG)的风险分层。虽然这种临床风险分层已被证明在预后和预测价值上具有一定效果,但仍然需要更好的生物标志物来改进患者分层。
2023年12月4日,德国法兰克福大学 Peter J Wild 团队、西湖大学蛋白质组大数据实验室郭天南团队、苏黎世联邦理工学院 Ruedi Aebersold 团队合作在 Life Science Alliance 上发表新的文章Proteomic-based stratification of intermediate-risk prostate cancer patients。

图1 论文截图
文章通过质谱分析前列腺癌患者组织样本,提供了一个全面的蛋白质组学研究,发现了特定的蛋白质表达模式,并构建了一个基于18个蛋白的前列腺癌患者生存风险评分系统,为前列腺癌的分子诊断和治疗提供了深入洞察。
研究样本
来自 278 名患者的 1,348 个匹配的肿瘤和良性样本
研究方法
蛋白质组学、差异表达、机器学习和生存分析等
研究结果
- 前列腺组织样本的蛋白组学研究
研究人员选择了来自前列腺癌回顾性队列的290名患者(包括GG1到GG5的所有范围),从这些患者中获得了1,348个匹配的肿瘤和良性前列腺增生组织样本(其中12名患者由于质量控制步骤而被移除)。整个队列中有198名患者具有生化复发(BCR)数据,中位随访时间为59个月。大多数患者属于GG2(N = 135),其次是GG3(N = 70)。
*生化复发(BCR)是一个表明前列腺癌患者预后不良的指标
胰腺癌论文pdf.pdf.80ce492ac324dcbf6841f9f0478e685b.20231211194359766_07_副本.png)
图2 前列腺组织样本的蛋白质组分析,其中A为研究设计方案
研究人员使用DIA-MS技术在ProCan中进行了所有样本的蛋白质组学分析,总共鉴定了5,803种蛋白质。其中肿瘤样本显示出更多的蛋白质(平均每个样本3922种),而良性样本的平均蛋白质数量为3587种。
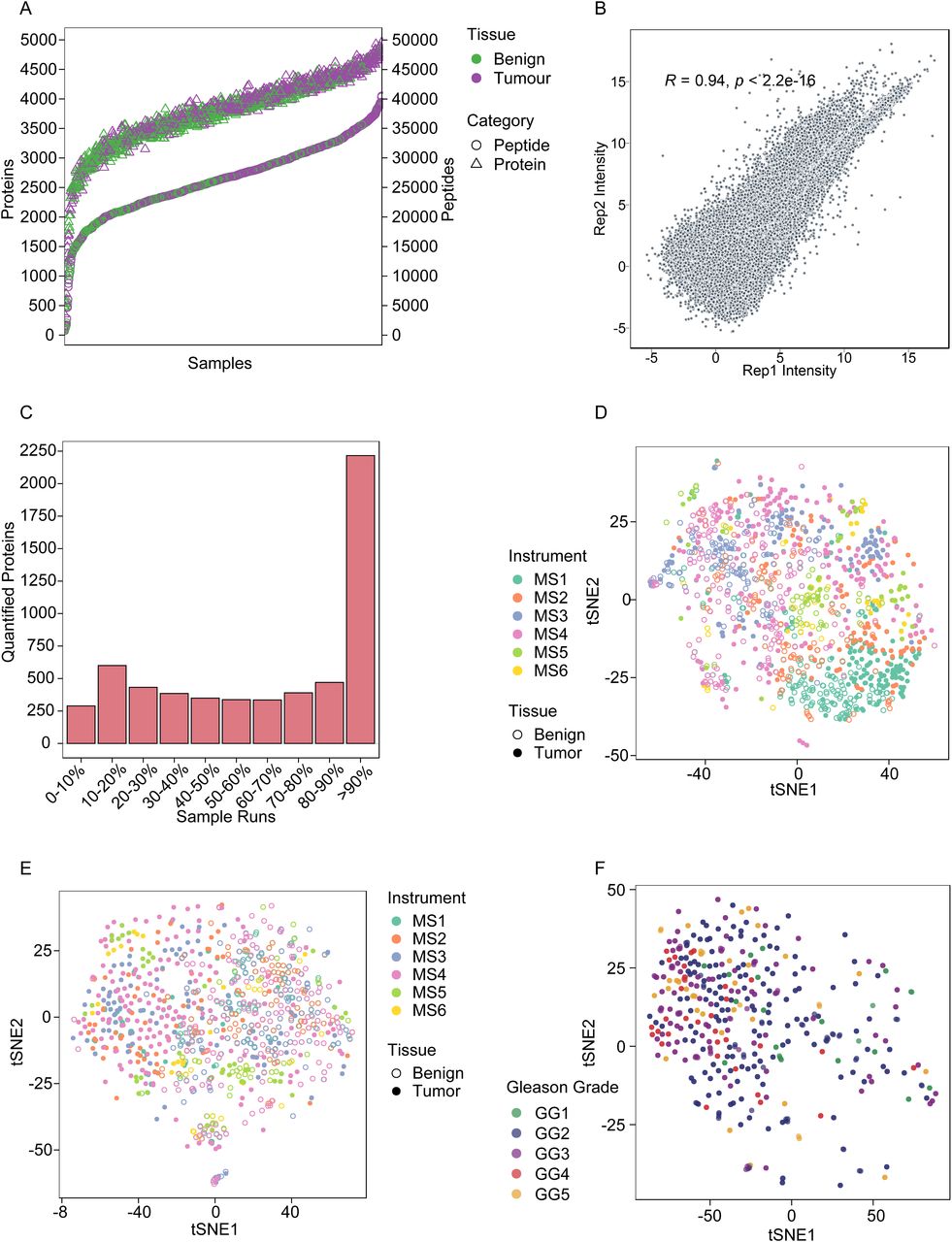
图3 蛋白质组数据概览
2. 通过差异表达分析在肿瘤和良性样本之间进行预处理
研究人员使用Pearson相关系数评估了样本之间的技术重复性,结果显示所有样本的技术重复之间有很高的相关性(平均Pearson r为0.94)。tSNE分析显示在样本制备过程中未观察到批次效应,经过DIA-NN归一化后,质谱仪之间也未观察到批次效应。tSNE分析还显示了良性和肿瘤样本之间的明显差异。蛋白质矩阵的热图显示了良性和肿瘤样本的不同表达模式,但GG系统本身并不能解释蛋白质组学的异质性。通过差异表达分析,研究人员鉴定了512个在肿瘤样本中富集的蛋白质(其中368种在肿瘤样本中上调,144种下调),这些蛋白用于后续分析。
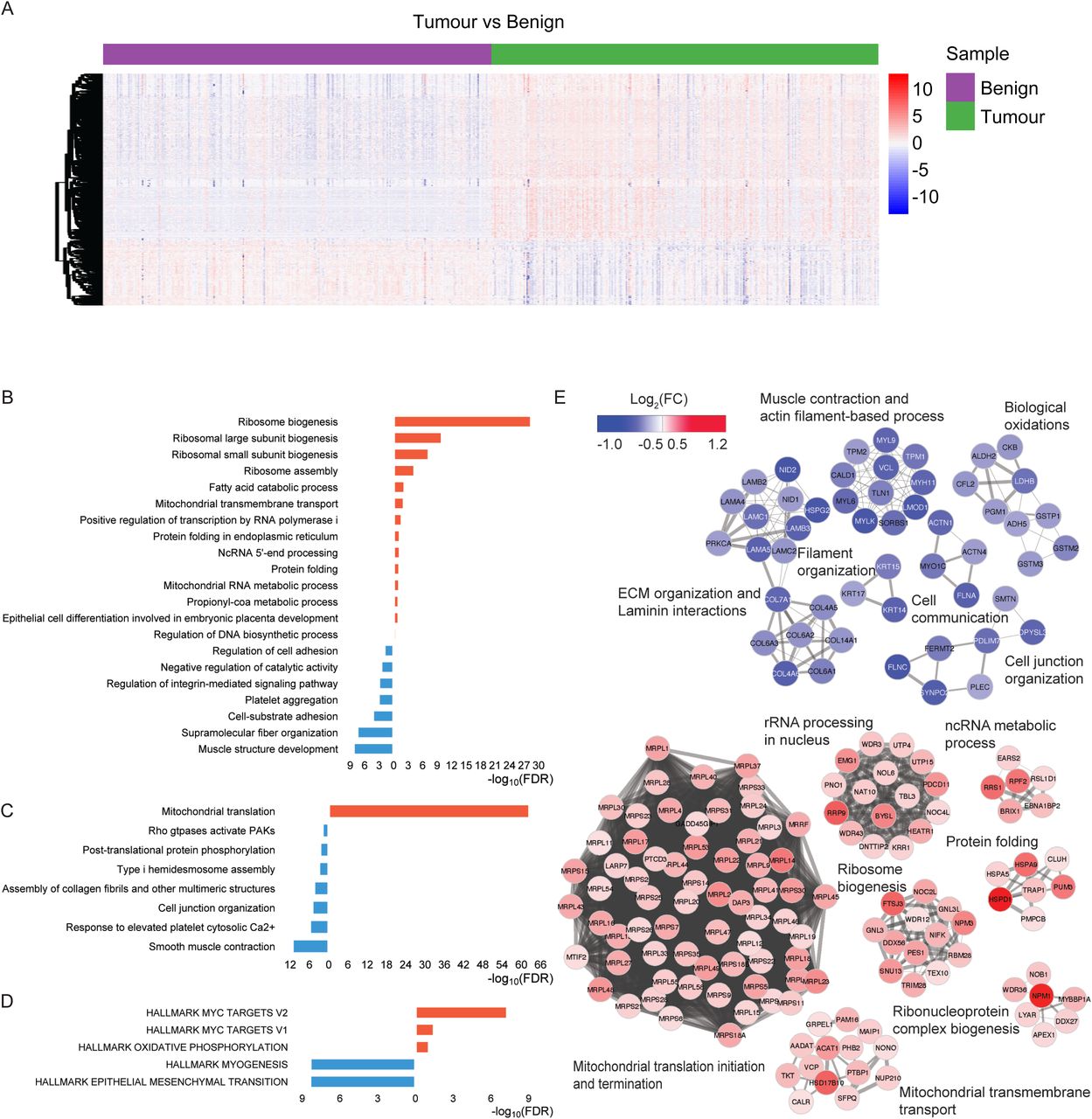
图4 肿瘤样本中的失调通路
3. 对 GG2 和 GG3 患者进行分层
通过对GG2和GG3患者使用这512种肿瘤富集蛋白进行差异表达分析,研究人员发现了35种在GG2中富集的蛋白和1种在GG3中富集的蛋白。这些蛋白的表达模式显示在两个GG中存在差异。尽管在GG2和GG3之间未发现显著富集的途径,但35种在GG2中富集的蛋白中有两种与雄激素受体途径有关,4种与FDA批准的药物有关。
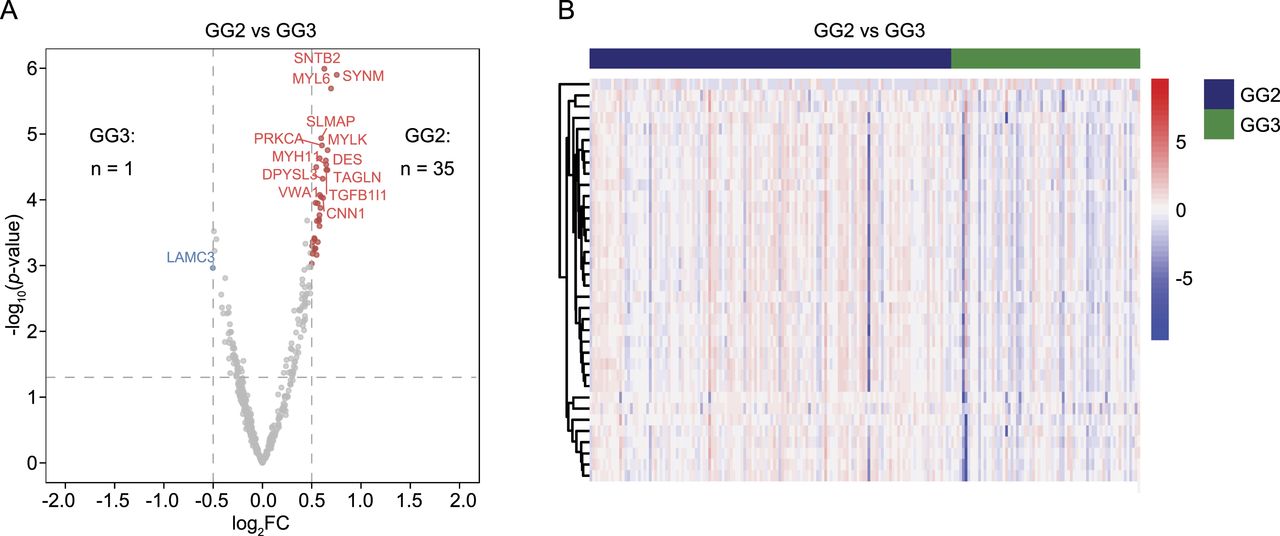
图5 GG2 与 GG3 中表达差异的蛋白质
机器学习的结果表明,通过蛋白质强度可以高准确度地预测GG2和GG3之间的差异(其ROC曲线的AUC为0.89)。
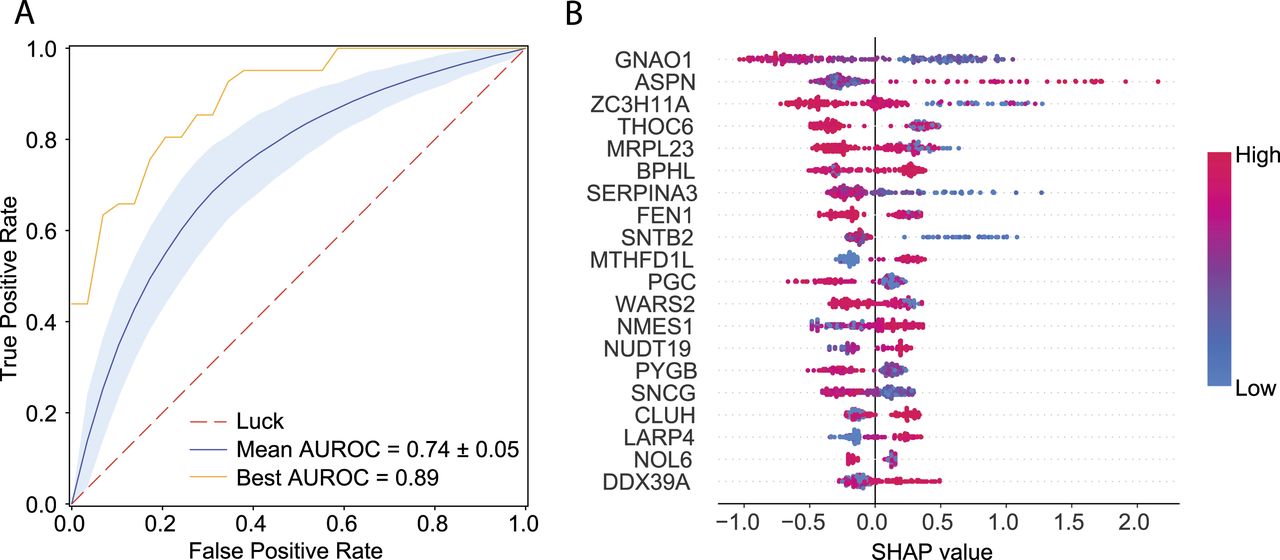
图6 GG2与GG3的机器学习
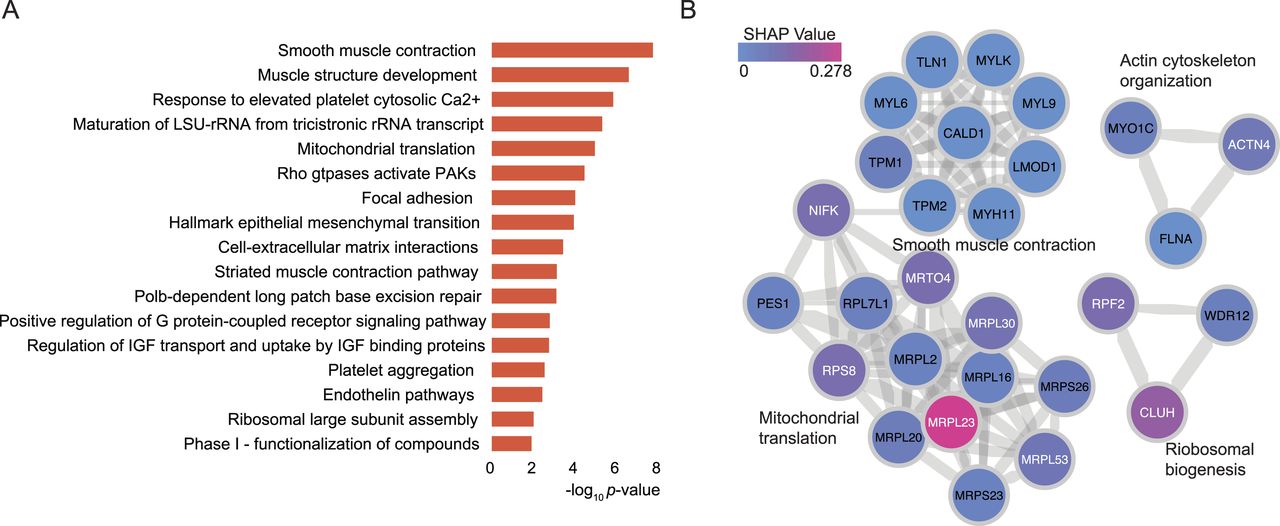
图7 在GG2和GG3前列腺癌中差异表达的蛋白质和通路
4. 构建基于蛋白质的预后标志物,用于生化复发预测
为了克服GG系统的局限性(特别是在无法区分GG2和GG3的情况下),研究人员通过进行多元Cox回归分析和LASSO正则化,构建了一个包含18个蛋白质的预后标志物,能够有效区分高风险和低风险组。这个18蛋白标志是独立于GG、其他临床病理变量和其他蛋白标志的独立预后因子,克服了GG在区分中风险前列腺癌患者方面的局限,并且在预测方面具有比标准分类更高的预后价值(C-index为0.95)。
通过蛋白质组学分析,研究人员鉴定了与生化复发相关的39种蛋白质,其中5种在Human Protein Atlas数据库中列为FDA批准的可靶向蛋白质,3种列为潜在的可靶向蛋白质。虽然这些蛋白质与已发表的前列腺癌侵袭性或治疗耐药性的潜在生物标志物列表没有重叠,但它们有望成为治疗靶点。其中,F5、TMEM126B和EARS2被认为与生化复发的风险增加有关,具有潜在的临床应用前景。
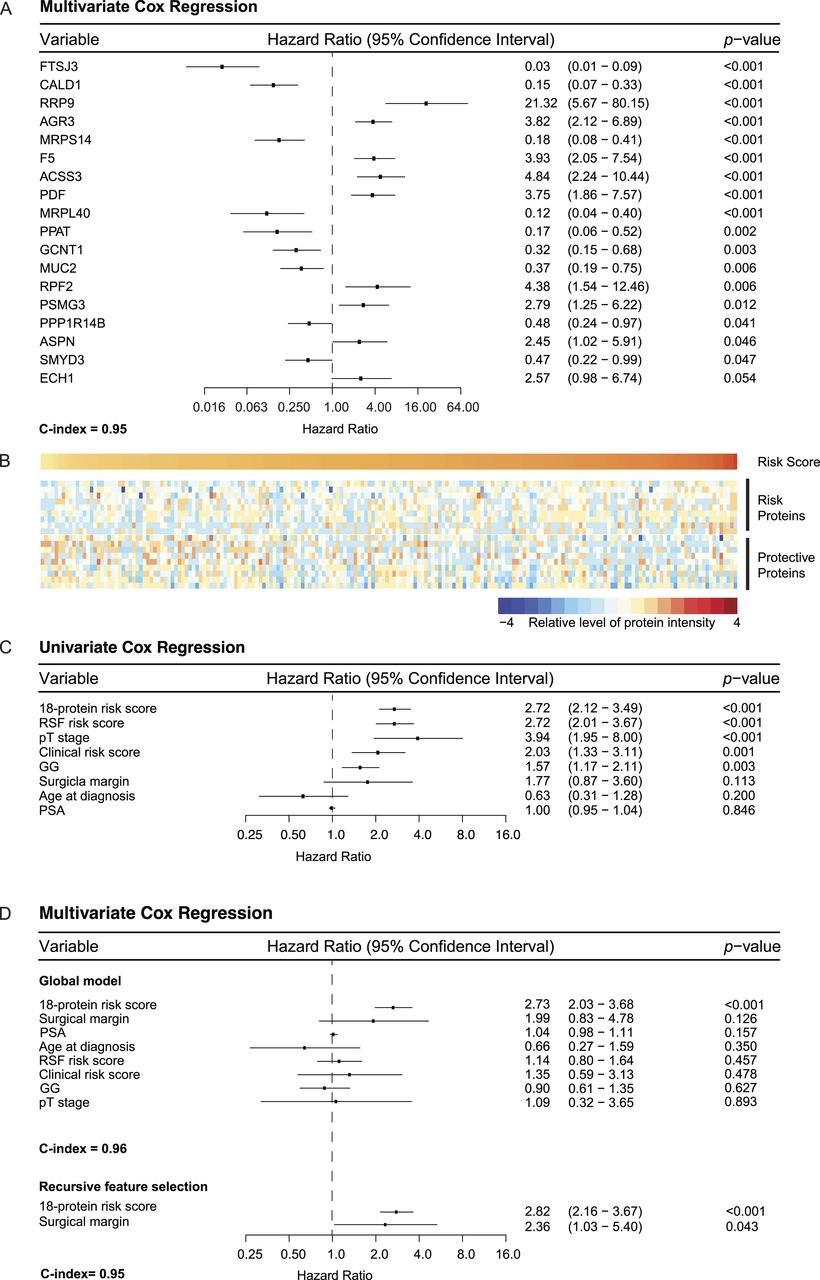
图8 针对前列腺癌无生化复发生存期(BCRFS)的生存分析
文章小结
总的来说,在对278名前列腺癌患者进行大规模定量蛋白质组学分析后,研究人员发现了与前列腺癌发展和进展相关的不同表达的蛋白质和多个信号通路。
虽然该研究也存在一些限制(例如未能验证18种蛋白质在其他Gleason分级中的效果,并且需要进一步的研究验证其在临床实践中的应用),但前列腺癌蛋白质组学分析仍是理解与前列腺癌发展和进展相关的生物途径的有希望的工具。
这项研究为通过蛋白质组学分析提供的前列腺癌分类和预后信息提供了有力的支持,同时突显了蛋白质标志物在超越传统临床指标的潜在优势。
文章链接:
https://www.life-science-alliance.org/content/7/2/e202302146