
上周,慕尼黑工业大学 Bernhard Kuster 教授团队在Nature Biotechnology (IF=46.9)上发表关于新型质谱仪 Orbitrap Astral 的观点文章 A new mass analyzer shakes up the proteomics field。
文章指出,Orbitrap Astral质谱仪结合了高速度、高灵敏度、高分辨率和高质量的特点,能够实现高通量的蛋白质鉴定和定量分析,从而推动蛋白质组学领域的发展,“对蛋白质组学领域产生了颠覆性的影响”(shakes up the proteomics field)。
以下为观点全文。
“这一新型质谱仪能够快速、高深度地鉴定蛋白质。”
2023年6月,Orbitrap Astral 高分辨质谱亮相美国质谱年会(ASMS),此举可谓令蛋白组学界为之振奋。在Orbitrap质谱仪中加入非对称轨道无损质量分析器Astral后,可实现较高的数据采集速度、灵敏度、分辨率和质量精度。
本月初,Guzman等人在 Nature Biotechnology 上发文(图1),介绍了这一新型质谱仪的优势,并表明蛋白质组分析的深度因此而更加全面,同时还能在1天内分析48个人类蛋白质组或100个酵母蛋白质组。文章指出,该仪器结合了两种模式的优点,既能系统地选择肽段,又能在最有效的质量范围内进行窄范围选择测序,因此消除了DIA和DDA采集模式之间的差异。换句话说,科学家们不必再事先决定是要发现样品中的未知蛋白质(DDA的优势),还是要持续检测样品中假定存在的蛋白质(DIA的优势)。

图1 论文截图
在蛋白质组学技术的发展周期中,样品制备、色谱和质谱设备以及数据分析软件的改进一直在快速进行,并不断相互挑战(图2)。在这三个领域取得的重大突破包括:十二烷基硫酸钠(SDS)作为通用的 “蛋白质溶剂”、Orbitrap质谱仪、离子迁移谱技术与飞行时间质谱的结合以及人工智能在蛋白质鉴定中的应用。
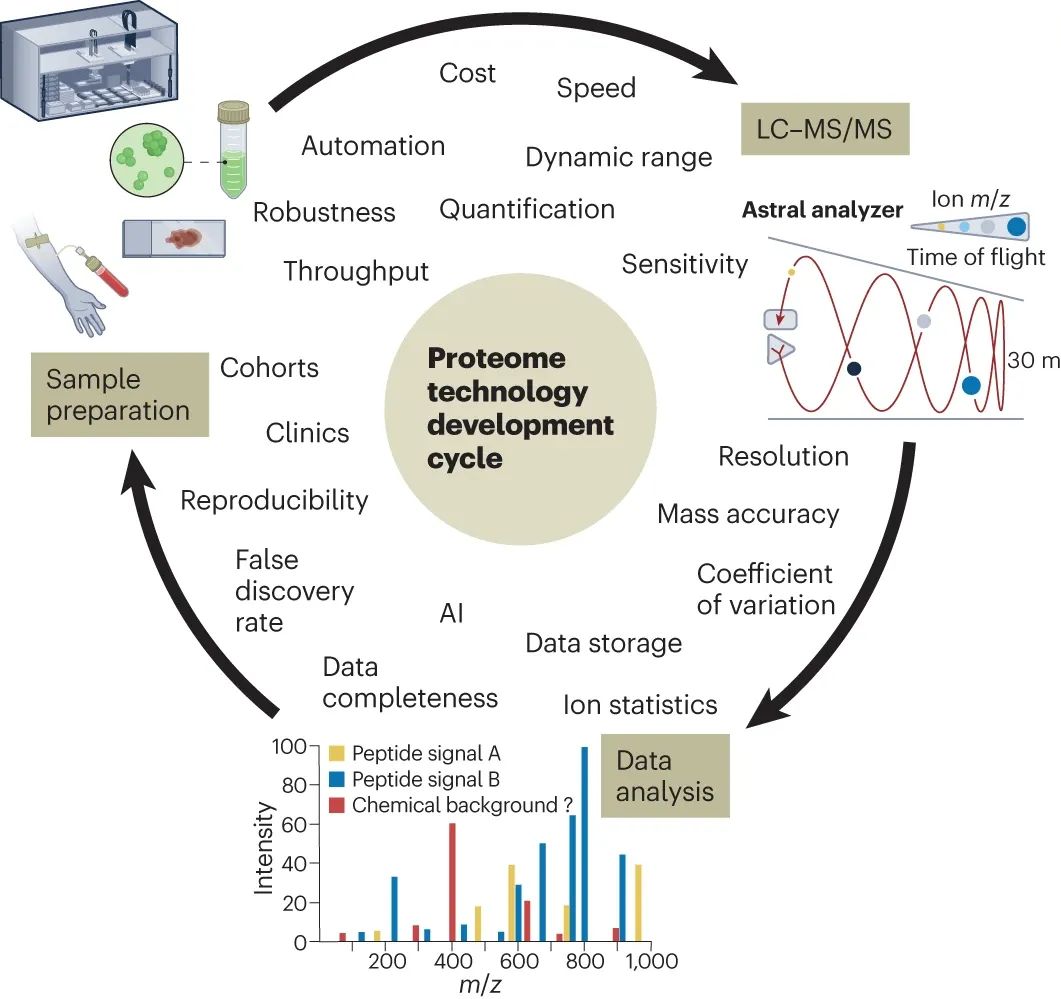
图2 蛋白组学技术开发周期
如今,这款新的 Orbitrap Astral 高分辨质谱再次大幅提升了蛋白质组学的水平。其核心是Astral飞行时间(TOF)质谱仪,其中肽片段离子包被连贯地注入一个开放式静电阱,在两个略微不对称的镜面之间摆动,从而沿着约30米的飞行路径进行离子分离,并最终进行离子检测。这种配置同时提供了高速度(每秒高达200个串联质谱)、质量精确度(肽段通常为1 ppm,片段通常为4 ppm)、质量分辨率(高达80,000 )和灵敏度(单离子检测),所有这些都是高质量、高深度和高通量蛋白质组学分析的重要参数。
Guzman等人主要从高通量的角度出发,但也为蛋白质组科学家每天都要面对的一个问题提供了指导:考虑到可用的样本量(灵敏度)、待分析样本的数量(稳健性和仪器时间)以及所需的蛋白质组学深度(实验室和仪器时间),什么才是适合当前项目分析的好方法?至少在测量蛋白质组表达方面,普遍的答案似乎是:对整个蛋白质组进行一次性分析。
例如,Guzman等人在样品数量不受限制的情况下,仅用8分钟的测量时间就鉴定出了超过4,000个酵母蛋白质(表达蛋白质组覆盖率为75%),并在半小时内从癌细胞系制备物中鉴定出了10,000个人类蛋白质(表达蛋白质组覆盖率为60%)。对于稀缺样品,必须找到一个平衡点,既能收集更多离子(有效减慢仪器速度),又能捕获所有肽段中的大部分——有效扩大肽段选择窗口或选择更少的肽段。通过这种方法,作者证明了在单个HeLa细胞中能以可接受的定量精度检测到约4,500个蛋白质。
为了证明新型质谱仪分析性能的提高已转化为实际应用能力,作者用5分钟的分析时间分析了一个包含104株酵母基因敲除菌株的不同菌株库,获得了4,300个蛋白质的一致检测结果,大多数蛋白质的定量变异系数(CV)优于10%。这再现了早期的系统生物学实验,但所需时间仅为其十分之一。在第二项应用中,对45名多系统萎缩患者和29名对照组的样本进行了分析,在短短两天的分析时间内,几乎所有患者的7,000多种蛋白质都得到了检测。这超越了同一研究小组的早期成果,即在二十分之一的时间内蛋白质组覆盖率提高了60%,或在五分之一的时间内蛋白质组覆盖率提高了90%,并同时鉴定出了更多不同表达的蛋白质。
毫无疑问,新型 Orbitrap-Astral 质谱仪在性能上远远超过了以前的Orbitrap技术。速度和灵敏度的提高无疑将使许多蛋白质组学研究成为可能,尤其是在分析大量样品或样品量较少的情况下。遗憾的是,速度和灵敏度的提高仍无法一蹴而就,尤其是单细胞分析,目前仍将在通量和蛋白质组深度问题上苦苦挣扎。我们还注意到,2023年在蛋白质组学领域推出的第二款值得关注的仪器timsTOF Ultra也具有类似的性能,但目前的研究没有进行比较。毫无疑问,此类比较报告很快就会发布,其中会突出强调这两种系统的特定优缺点(如果有的话)。
Guzman等人未能探索所有可能的应用,他们很想知道新仪器在分析更多类型的样本时表现如何,例如体液(蛋白质浓度的高动态范围挑战)、翻译后修饰(低丰度和化学计量学)、保存在福尔马林和石蜡等中的存档生物样本(化学修饰)或蛋白质组的多重分析(稳定同位素标记)。特别是从高通量临床蛋白质组学的角度来看,了解随时间变化的性能指标、相关的质量控制和维护周期,以及这些因素如何影响对大型患者队列进行稳健分析的能力也非常重要。
虽然作者广泛使用CV作为定量精确度的指标,但这方面还需要进一步探讨,因为提高速度通常会影响定量的质量。当使用狭窄的肽段选择窗口和较短的液相色谱时间时,目前不可能在一个色谱峰上进行多次测量。因此,必须仔细评估简单的CV计算或三种物种蛋白质组混合物等受控比率样本是否是评估定量性能的适当指标。
新的仪器也给信息学工具提出了新的挑战。由于每小时产生10 GB或更多的数据,目前还不清楚如何在ProteomeXchange联盟的存储库中实现FAIR(可查找、可访问、可互操作和可重用)数据共享。更重要的是,蛋白质鉴定和定量软件需要在几个方面进行仔细的重新评估。仪器的高速运转会产生大量串联质谱,需要与序列数据库或谱库进行匹配。只有对用于此目的的模型进行很好的校准,才有可能进行适当的误差控制,而随着数据的积累,这个问题变得越来越重要。
与此相关的一个问题是,快速数据采集和单离子检测能力会产生许多 “噪声” 光谱(即含有少量和/或低丰度碎片离子)。由于这种离子统计学差,通常无法将碎片离子强度作为肽鉴定标准。此外,在单离子灵敏度水平上,不能再想当然地认为检测到的离子就是肽。这是因为与肽段相同化学元素组成的其他生物大分子也会偶然产生“看似是肽但其实不是”的前体和碎片离子。要解决后一个问题,就必须为质谱分析制备更纯净的样品,这将使蛋白质组技术的开发周期再次闭环。
文章链接:
https://www.nature.com/articles/s41587-024-02129-y









