在酿酒酵母(Saccharomyces cerevisiae)的自然分离株中,非整倍性(染色体拷贝数不平衡)现象普遍存在(约20%),这似乎与实验室人工制造非整倍体所需颇丰的适应性代价(fitness costs)和短暂性相矛盾。目前,对天然菌株的研究尚未扩展到蛋白质组。
5月22日,德国柏林夏里特医学院生物化学系主任 Markus Ralser 教授团队及合作者将高通量和数据非依赖性采集蛋白质组学方法应用于天然的酿酒酵母分离物,在Nature发表了新的文章 Natural proteome diversity links aneuploidy tolerance to protein turnover。

图1 论文截图
研究人员使用了796个自然分离株(包括非整倍性和整倍性),通过蛋白质组学方法分析它们的蛋白质表达情况。此外,还生成了8个分离株的泛素组数据和55个分离株的蛋白质周转数据,通过多组学数据整合,并分析了这些分离株的蛋白质组特征。
文章揭示了酵母自然遗传多样性中染色体非整倍体耐受性与蛋白质周转之间的关联,并指出了蛋白质剂量补偿在染色体非整倍体耐受性中的重要作用。
结果1:
天然酵母多组学数据的生成和整合
研究人员通过SWATH质谱技术,生成了933株全球自然酵母菌株的蛋白质组数据,并整合了这些菌株的基因组和转录组数据。最终在796株菌株中保留了7946个前体,定量了1576种蛋白质。
研究发现,染色体非整倍体普遍存在于这些自然分离物中,且染色体增益比丢失更为常见,其中染色体1、9和3最常见非整倍体现象。
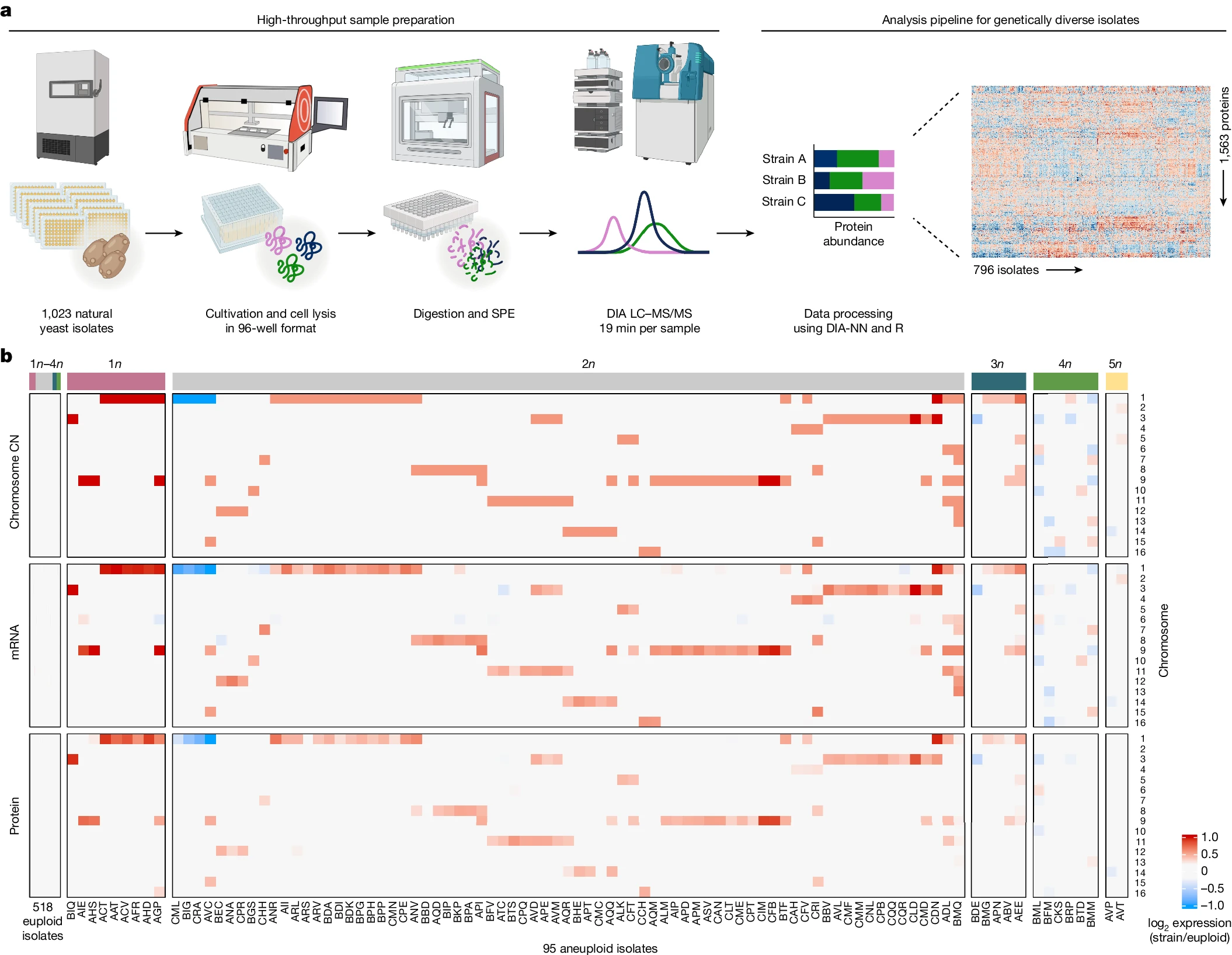
图2 高通量蛋白质组学流程和跨组学数据集
结果2:
天然酵母非整倍体中的剂量补偿
研究人员发现,在基因层面上,转录水平和蛋白水平都显示出高程度的剂量补偿;尤其在蛋白水平上,70.5%的蛋白质表现出剂量补偿。
此外,与实验室菌株相比,天然菌株中蛋白质的剂量补偿更显著。且剂量补偿程度与蛋白质的功能、泛素化位点数量、蛋白质-蛋白质相互作用以及蛋白质丰度的变化等因素相关。
整体来看,天然菌株在染色体层面表现出广泛的剂量补偿。
结果3:
自然酵母非整倍体中的UPS(泛素-蛋白酶体系统)激活
研究发现,非整倍体对转录水平的基因表达产生影响。通过分析转录特征,研究人员发现自然分离株显示出类似于环境应激反应(ESR)、非整倍体相关蛋白质特征(APS)和常见非整倍体基因表达(CAGE)的这三种转录特征。
然而,这些转录特征在不同的分离株中表现出高度异质性,并且在蛋白质水平上并未得到充分体现。
进一步的基因集富集分析表明,自然分离株中的蛋白质组中高度富集了与蛋白酶体相关的基因。这一发现提示,在自然非整倍体中,蛋白酶体成分受到诱导,而在实验室构建的非整倍体中并未观察到这种现象。
结果4:
蛋白质周转和剂量补偿
研究人员假设蛋白酶体(proteasome)通过加速蛋白质降解和更新来介导剂量补偿。研究发现,在非整倍体染色体上编码的蛋白质的泛素化水平增加,并且这些蛋白质的周转率较快,表现出更强的剂量补偿。
通过动态SILAC实验,研究人员测量了自然分离株的蛋白质周转率,发现自然非整倍体中蛋白质的周转率显著高于正常染色体上编码的蛋白质,且蛋白质周转率与剂量补偿程度相关。
总体而言,这些结果表明蛋白质降解和更新在剂量补偿中起着重要作用。
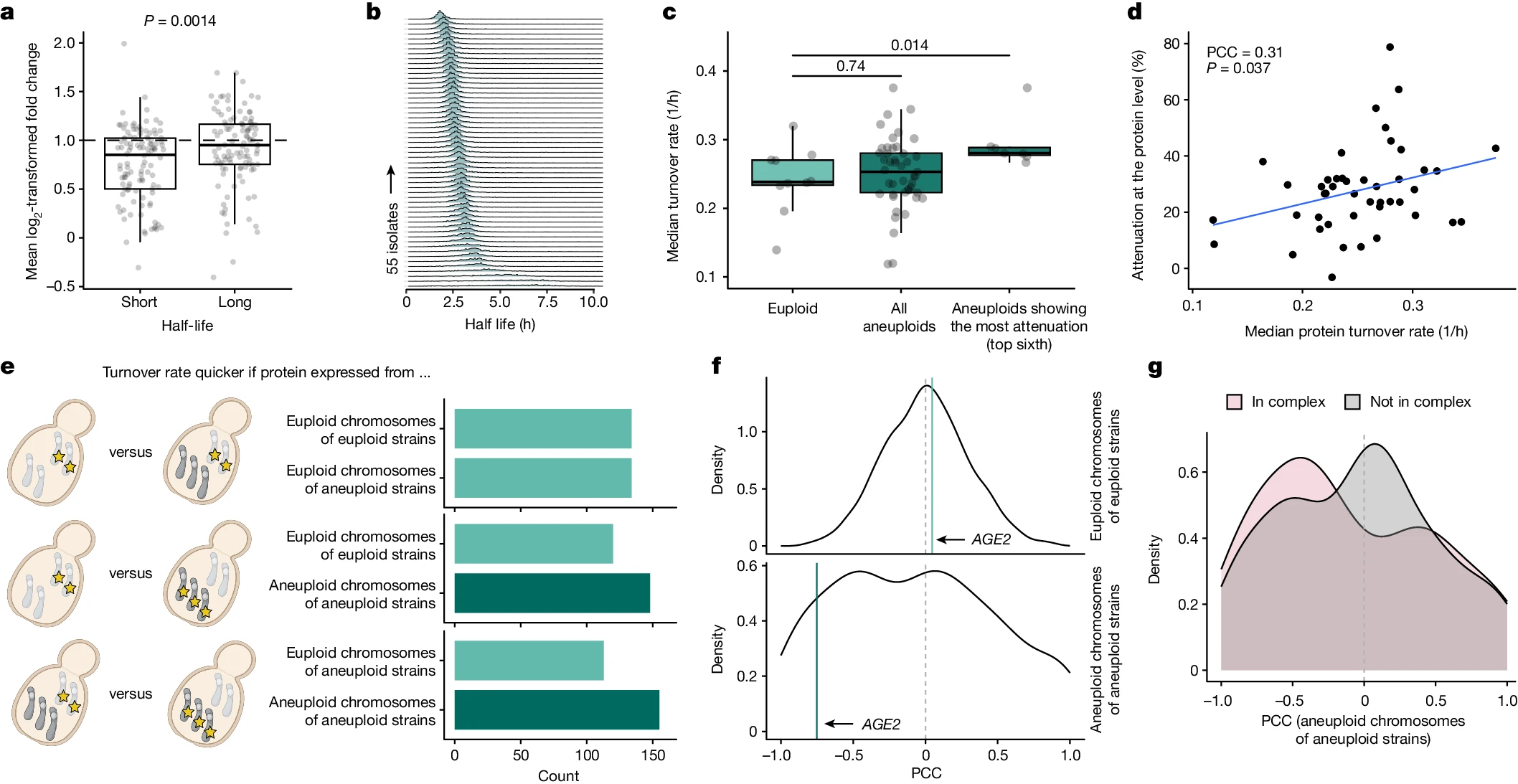
图3 天然分离物中蛋白质周转率的增加与剂量补偿有关
总 结
总的来说,这项研究通过对酿酒酵母的天然分离体进行综合分析,提供了关于染色体非整倍体耐受性与蛋白质组水平关联的重要见解。
这些见解为探索复杂生物过程的通用分子洞见提供了新的方法,同时,研究人员还呼吁更多地利用自然物种的多样性来获取更广泛的生物学洞见。
文章链接:
https://www.nature.com/articles/s41586-024-07442-9
Markus Ralser 教授简介

Markus Ralser 出生于意大利,后在奥地利萨尔茨堡学习遗传学和分子生物学,并于德国柏林的马克斯·普朗克分子细胞生物学与遗传学研究所获得神经退行性疾病的博士学位。
自2013年以来,Markus 一直是伦敦弗朗西斯·克里克研究所的研究组组长。2018年,他在柏林Charité大学医学院(柏林洪堡大学和自由大学的联合医学院)担任生物化学系主任。
2021年,Markus Ralser 团队开发出超快速蛋白质组学分析方法Scanning SWATH,可应用于药物作用模式筛选和血浆蛋白质组学等场景。文章于当年3月发表于 Nature Biotechnology。

文章链接:
https://www.nature.com/articles/s41587-021-00860-4









