胶质瘤(Gliomas)是一种高度异质性且预后不良的中枢神经系统恶性肿瘤。过去20年来,胶质瘤组学研究迅速发展,进入“后基因组时代”。然而,越来越多的研究表明,仅依赖基因组或转录组信息难以全面揭示肿瘤的发生发展的全貌机制。蛋白质作为执行生物学功能的重要大分子,也几乎是所有药物的作用靶点,因此蛋白质组学研究越发受到重视。
2024年11月19日, 复旦大学附属华山医院毛颖/花玮/杨辉教授团队在 Nature Communications 上发表了题为 Proteomic profiling of gliomas unveils immune and metabolism-driven subtypes with implications for anti-nucleotide metabolism therapy 的研究论文。
这项研究通过大规模高通量蛋白质组学分析,首次从蛋白质层面揭示了脑胶质瘤的两个全新亚型——免疫亚型(S-Im)和代谢-神经亚型(S-Mn),并探索了核苷酸代谢通路在胶质瘤治疗中的关键作用。
图1 文章截图(点击跳转论文链接)
结果1:
胶质瘤蛋白质组学分析概览
研究对188名胶质瘤患者的343例肿瘤样本(包括154例生物学重复样本)和53例正常脑组织样本进行了基于DIA/SWATH技术的定量蛋白质组学分析,全面探讨了胶质瘤的蛋白质组学特征。
这些样本覆盖了不同的病理分级和分型,包括毛细胞星形细胞瘤、弥漫性星形细胞瘤、弥漫性少突胶质细胞瘤以及胶质母细胞瘤。
样本采集和分析采用了严格的质量控制措施,最终,研究人员定量了8561种蛋白,用于后续的综合分析。患者的中位年龄为49岁,其中男性占比为1.76:1,肿瘤主要分布在额叶和颞叶区域。通过随访,研究发现中位生存时间为26.7个月,其中30.8%的患者已去世,而大部分患者在研究终点仍在存活。这些样本为研究胶质瘤蛋白质组学特征及其临床相关性提供了坚实的基础。
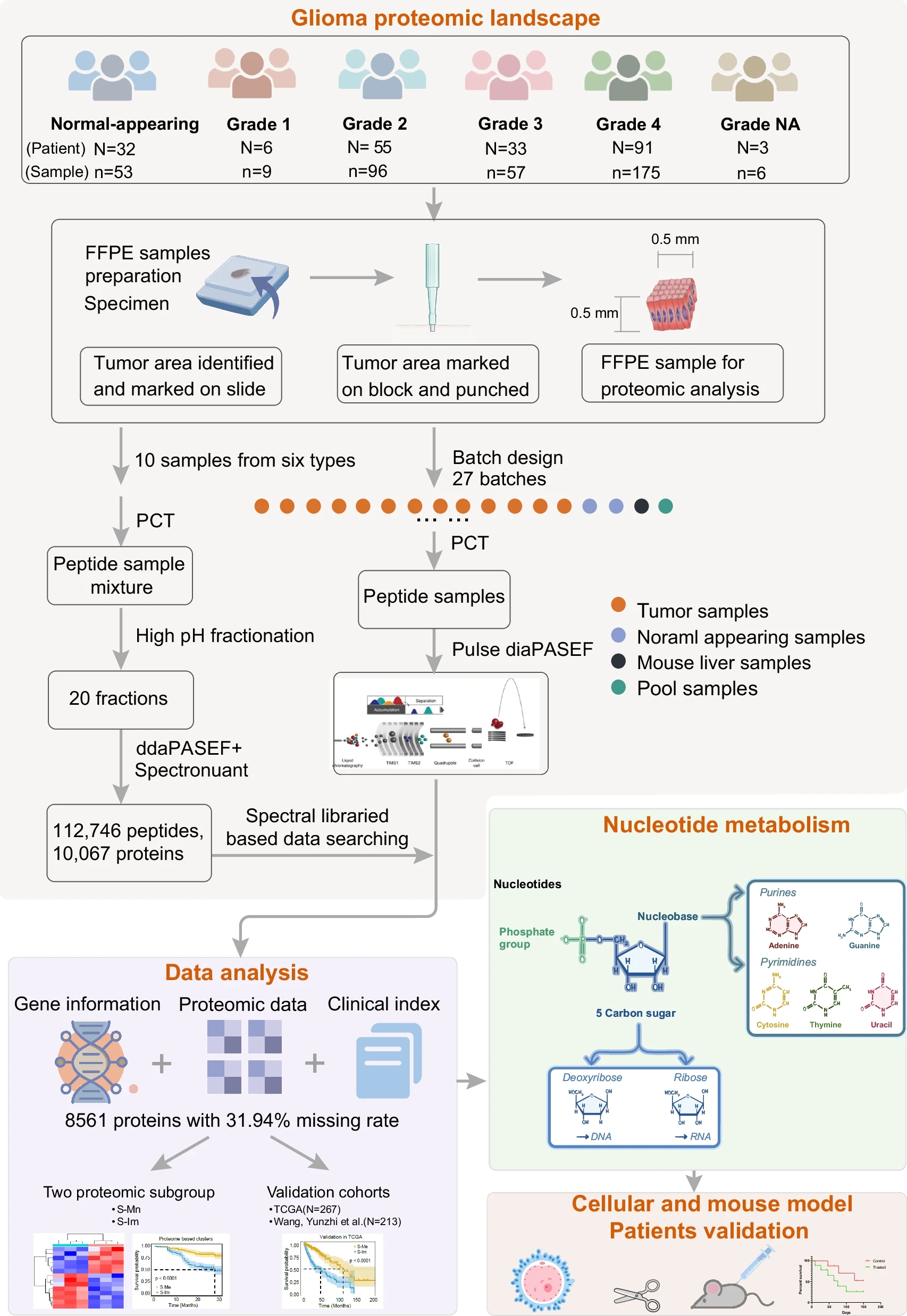
图2 研究流程:该研究整合了胶质瘤遗传数据、蛋白质组学图谱和临床信息,量化了8561种蛋白质以供下游分析。
结果2:
不同胶质瘤分类中的蛋白质组学特征差异
研究首先比较了胶质瘤样本和正常脑组织的蛋白表达水平,发现570种蛋白在两者之间存在显著差异,这些蛋白主要与神经传递、突触发生、神经炎症和PD-1信号通路相关,表明这些通路在肿瘤发生中发挥了重要作用。
在这570种差异表达蛋白中,28种免疫相关蛋白和51种代谢相关蛋白在肿瘤中显著上调,其中GPX7和SOAT1等代谢相关蛋白不仅与代谢异常有关,还与患者预后不良密切相关。
在胶质瘤的不同病理分级和亚型中,研究发现蛋白表达模式呈现明显差异,尤其是在低级别胶质瘤(LGG)和胶质母细胞瘤(GBM)之间。此外,蛋白质表达的聚类分析表明,胶质瘤的不同分型可以分为两个不同的cluster,其中一个主要富集蛋白翻译相关通路,另一个则与突触信号和代谢通路相关。
研究还鉴定出1047种在WHO 1-4级胶质瘤分级间显著差异的蛋白,这些蛋白富集在核苷酸合成、抗原呈递、干扰素和TGF-β信号通路中,表明代谢特性与免疫微环境之间存在复杂的交互作用。这些发现揭示了胶质瘤在分子水平上的复杂性以及不同亚型间的显著差异。
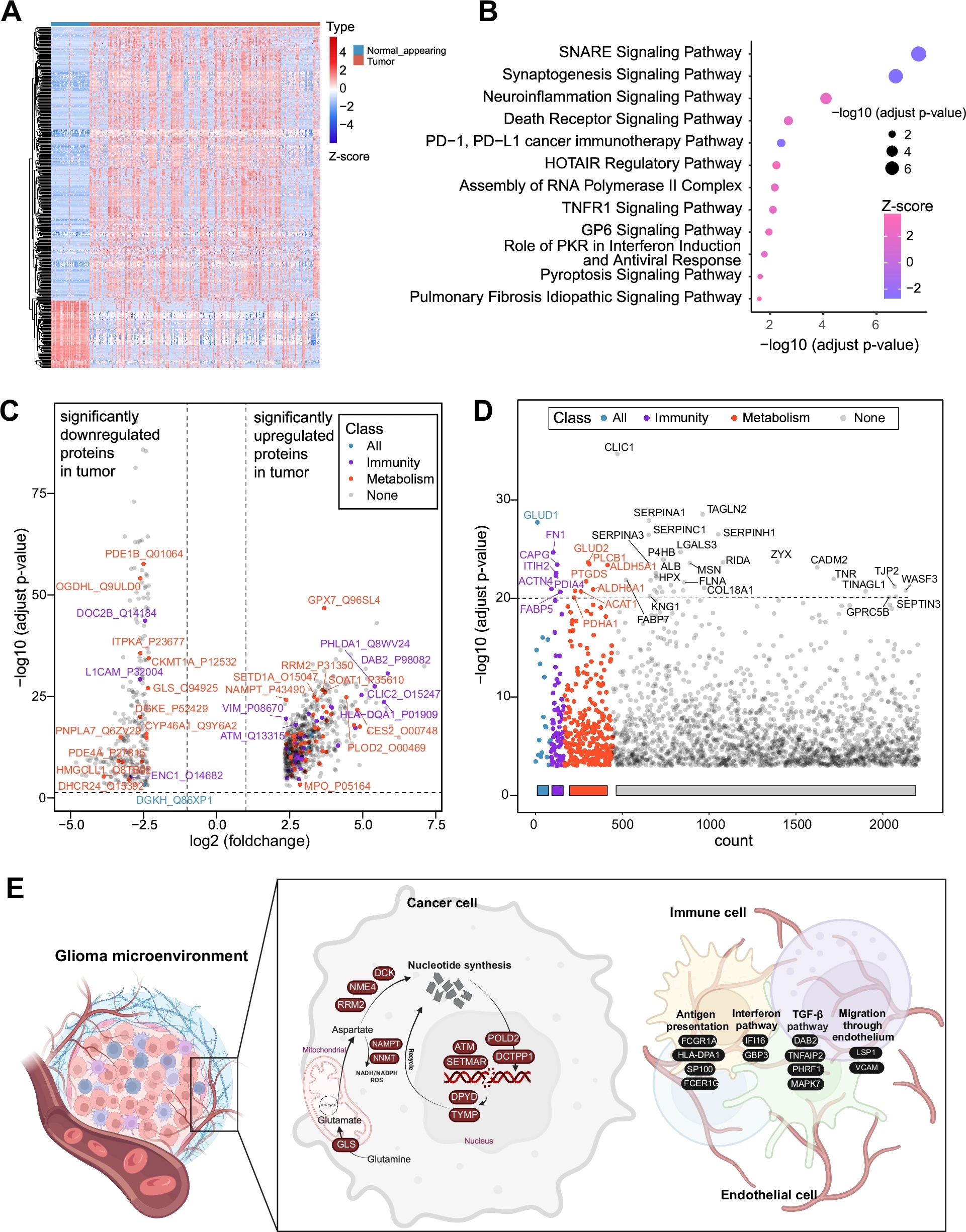
图3 不同胶质瘤临床分类的蛋白质组学特征各有不同
A 热图展示了343个肿瘤样本与53个正常脑组织样本之间的570种差异表达蛋白;
B 使用IPA对这570种肿瘤与正常脑组织之间的差异表达蛋白进行通路富集分析;
C 火山图展示了343个肿瘤样本与53个正常脑组织样本之间的570种差异表达蛋白,免疫相关和代谢相关蛋白分别用红色和紫色标记(28种免疫相关蛋白,51种代谢相关蛋白);
D 曼哈顿图展示了四个分级中1047种差异表达蛋白,免疫相关和代谢相关蛋白分别用红色和紫色标记;
E 富集的免疫和代谢过程,包括核苷酸合成、抗原呈递、干扰素信号和TGF-β通路。
结果3:
蛋白质组代谢神经和免疫亚型可预测临床结果
基于蛋白质组学数据,研究人员揭示了脑胶质瘤的两个全新亚型:神经-代谢亚型(S-Mn)和免疫亚型(S-Im)。
S-Mn亚型富集代谢酶和神经递质受体蛋白,涉及突触信号通路,表现出较好的临床预后;S-Im亚型上调免疫和炎症相关蛋白,如PD-1信号和死亡受体通路相关蛋白,与较差的临床预后相关。
该分类方法经过TCGA数据和独立数据集验证,表明其具有稳定性和广泛适用性,并独立于WHO分级和IDH突变。进一步分析表明IDH突变对代谢和蛋白表达有重要影响,IDH突变型胶质瘤中某些代谢酶(如GLUD1和GLUD2)上调,影响肿瘤代谢及脂质合成。
此外,不同分级的IDH突变肿瘤在蛋白表达和细胞周期调控路径上呈现显著差异,揭示了胶质瘤分级和恶性进展的分子机制。
结果4:
嘧啶代谢与胶质瘤患者生存间的关联
代谢重编程(metabolic reprogramming)是癌症的标志性特征之一,也是胶质瘤发生的早期事件。研究揭示了嘧啶代谢在胶质瘤患者生存中的关键作用,并显示其与肿瘤代谢重编程密切相关。
通过筛选89名患者(48名长期生存期≥30个月,41名短期生存期≤12个月)的代谢相关蛋白,研究人员最终确定了18种与代谢和预后显著相关的蛋白,并构建了基于这些蛋白表达的风险评分模型。模型显示,低风险组患者的生存时间显著高于高风险组,这一结论在TCGA数据中也得到了验证。
进一步分析发现,这些关键蛋白主要参与嘧啶代谢通路,这一过程与DNA和RNA的合成密切相关。研究强调,嘧啶代谢的重编程可能通过调控肿瘤细胞行为及患者生存发挥重要作用,揭示了这一代谢通路在胶质瘤恶性进展中的核心地位。
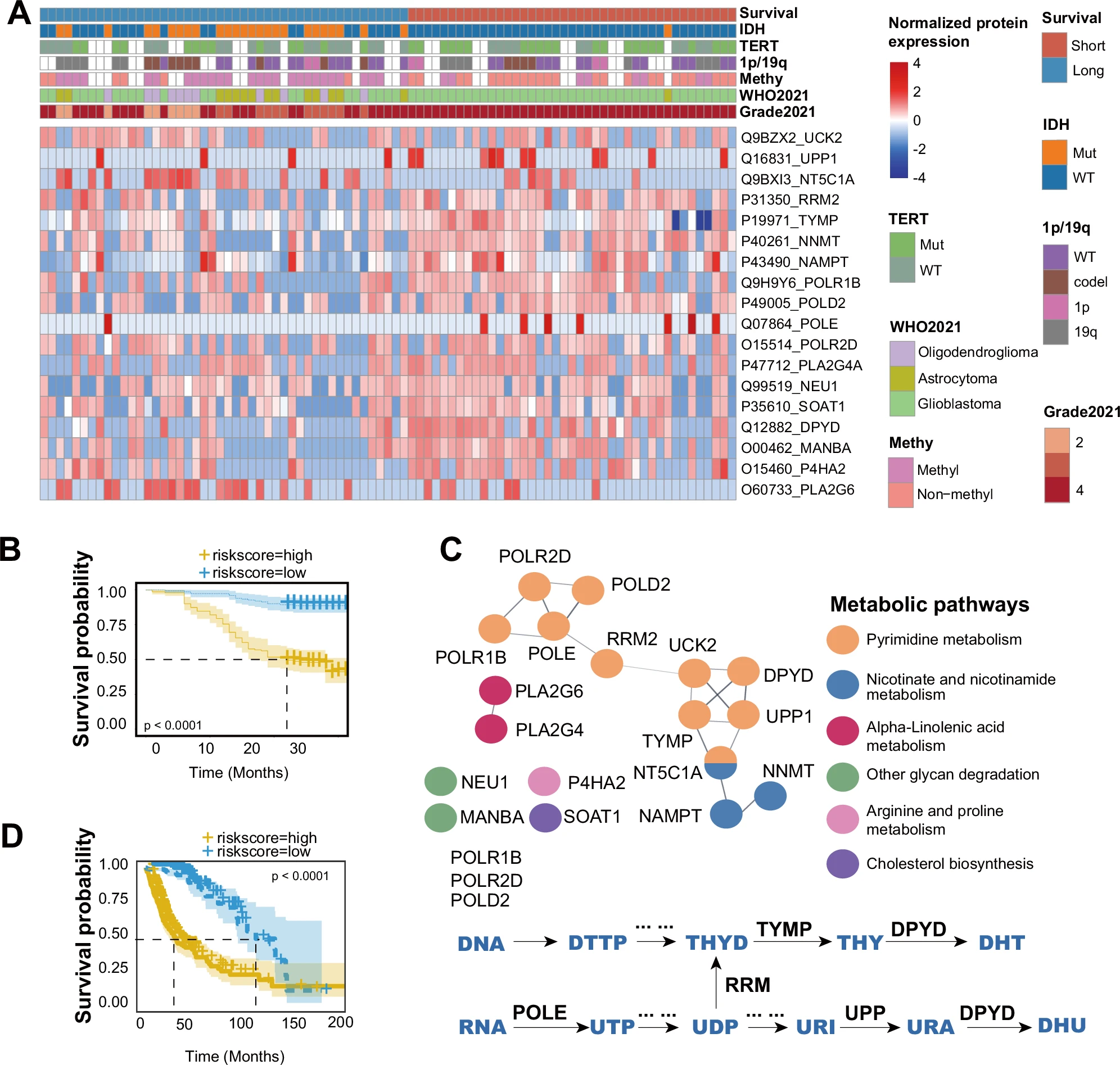
图4 嘧啶代谢与胶质瘤患者生存间的关联
A 热图显示长期生存期(N=48)和短期生存期(N=41)组之间18种不同的表达蛋白;
B 基于这18种蛋白的风险评分模型的Kaplan-Meier生存曲线(高风险组N=41;低风险组N=48,95%置信区间)表明了显著的生存差异。
C 通路富集分析显示嘧啶代谢在其中占主导作用;
D 使用TCGA数据的Kaplan-Meier生存曲线(高风险组 N=288;低风险组N=287,95%置信区间)验证了该风险评分模型的有效性。
结果5:
DPYD和TYMP对胶质瘤干细胞增殖和自我更新的作用
研究表明,嘧啶代谢相关酶DPYD和TYMP在胶质瘤干细胞(GSCs)的增殖和自我更新中发挥着关键作用。通过免疫组化验证和shRNA敲低实验发现,降低DPYD和TYMP表达显著抑制了GSCs的增殖能力、自我更新能力以及神经球形成,并导致DNA损伤和细胞凋亡。
动物模型实验进一步显示,敲低这两种酶能显著延长荷瘤小鼠的生存时间,并完全抑制肿瘤生长。此外,临床样本分析表明,DPYD和TYMP高表达与胶质瘤患者的不良预后相关。
这些结果强调了DPYD和TYMP在胶质瘤发生与进展中的重要性,支持了靶向核苷酸代谢作为治疗胶质瘤的潜在策略。
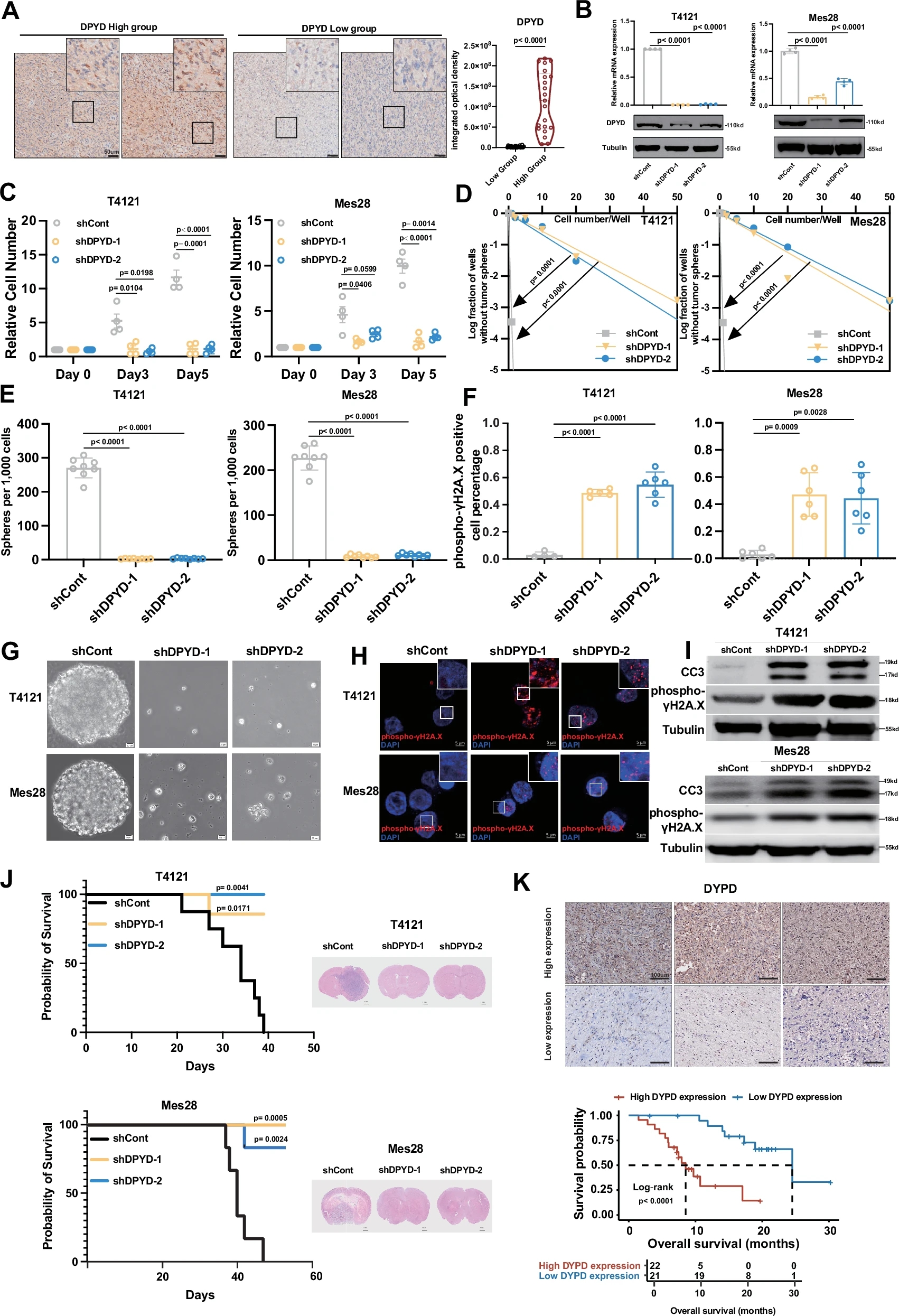
图5 DPYD和TYMP对胶质瘤干细胞增殖和自我更新的作用
总结
本研究通过蛋白质组学分析,揭示了胶质瘤的两种主要亚型(免疫亚型S-Im和代谢-神经亚型S-Mn)及其独特的分子特征,提出了基于蛋白质组的分类方法,并验证了嘧啶代谢及其关键酶DPYD和TYMP在胶质瘤进展中的作用。这些发现不仅深化了对胶质瘤分子机制的理解,还为发展以核苷酸代谢为靶点的治疗策略提供了理论支持和实验依据。
复旦大学附属华山医院毛颖教授、花玮教授、华山医院/脑科学转化研究院杨辉研究员为本文通讯作者,华山医院博士生张金森,吕莹莹,刘茶宪,西湖大学助理研究员孙瑞为共同第一作者。该研究得到了西湖大学郭天南研究员团队、复旦大学基础医学院病理学系刘颖教授、南京医科大学汪秀星教授和复旦大学叶丹教授大力支持。
点此查看论文链接