阿尔茨海默症(AD)是最常见的神经退行性疾病,其病理特征为β淀粉样蛋白(Aβ)斑块和神经原纤维缠结(NFTs)。AD患者通常表现为进行性认知能力下降。2018年,有研究者提出了基于Aβ沉积、磷酸化tau(p-tau)和神经退行性变来定义AD的研究思路。
目前临床上AD可以通过脑脊液Aβ、tau和p-tau水平和PET-CT检查进行诊断。然而,脑脊液采集具有侵入性,接受度差,往往难以常规实施;而PET-CT检查价格昂贵,难以在早期患者和无症状期人群中普及。开发便捷的AD早期诊断方法一直是该领域的瓶颈问题。
血液样本因其方便、微创等特点在取样上具有优势。近期有几种基于血液的AD生物标志物已有报道,如血浆Aβ42/40比值、p-tau、NEFL、GFAP等。但值得注意的是,目前上述标志物仍不适合于疾病分期。

图1 论文截图
2024年1月2日,浙江大学吴志英团队、西湖大学郭天南团队和首都医科大学附属宣武医院贾建平团队在 The Innovation 发表新文章:Alzheimer’s disease early diagnostic and staging biomarkers revealed by large-scale cerebrospinal fluid and serum proteomic profiling。浙江大学医学院附属第二医院神经内科陶青青副主任医师、西湖大学博士生蔡雪、浙江大学医学院附属第二医院博士生薛妍妍和(原)西湖大学数据分析科学家葛伟刚(现为西湖欧米生信总监)为该论文共同第一作者。该工作得到了浙江省重点研发计划、国家自然科学基金和科技创新2030 脑科学与类脑研究重大项目的支持。
该研究通过机器学习开发了用于AD早期诊断的19种脑脊液蛋白和8种血清的蛋白质panel,且验证了21种脑脊液和18种血清的核心的AD阶段依赖性失调蛋白。
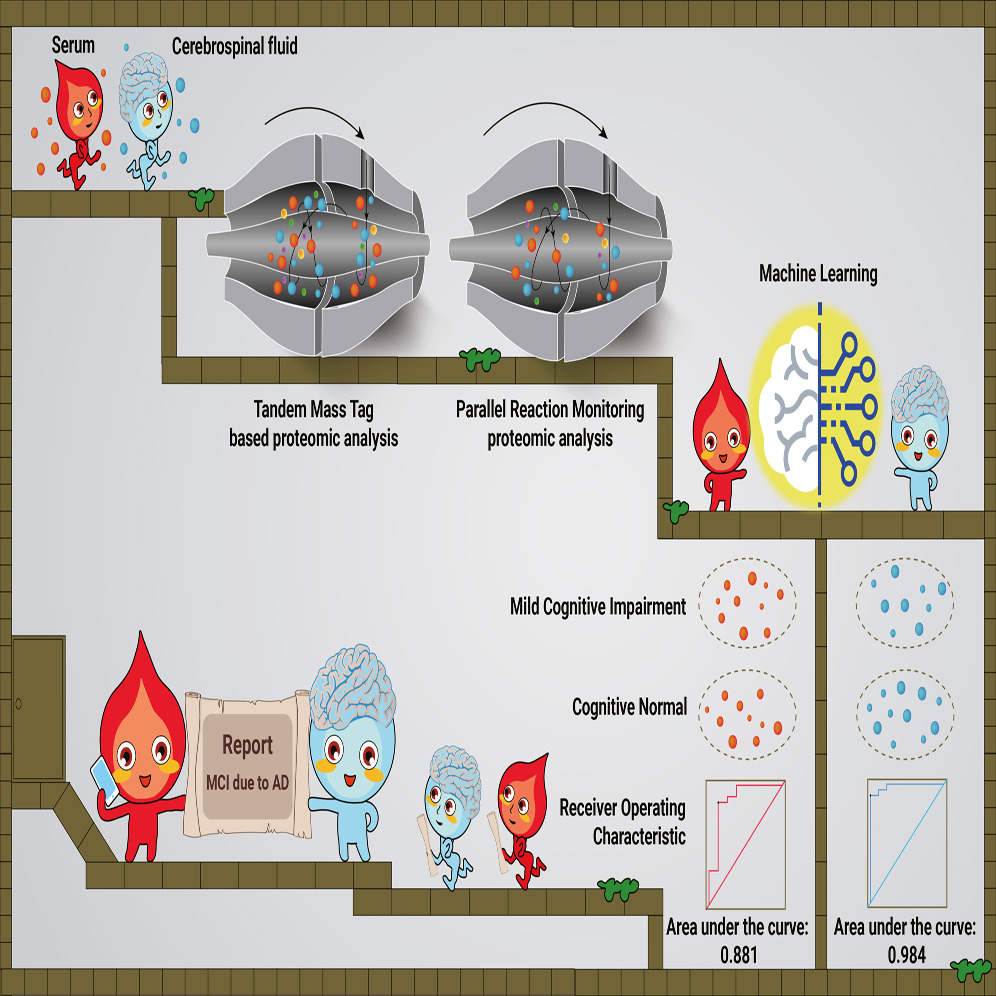
图2 血清和脑脊液助力AD早诊和分期标志物发现
研究样本及技术方法
1 发现队列(TMT蛋白组):AD源性轻度认知障碍(MCI due to AD)、早、中、晚期AD、亨廷顿病(HD)、肌萎缩侧索硬化症(ALS)患者以及正常对照(CN)参与者,共98名患者配对的脑脊液和血清样本,具体分组例数见下图;
2 验证队列(PRM靶向蛋白组):脑脊液221名参与者,组别包括AD,MCI, CN, HD, ALS, 前额颞叶痴呆(FTD); 血清288名参与者,组别包括AD,MCI, CN, HD, ALS。具体分组例数见下图。
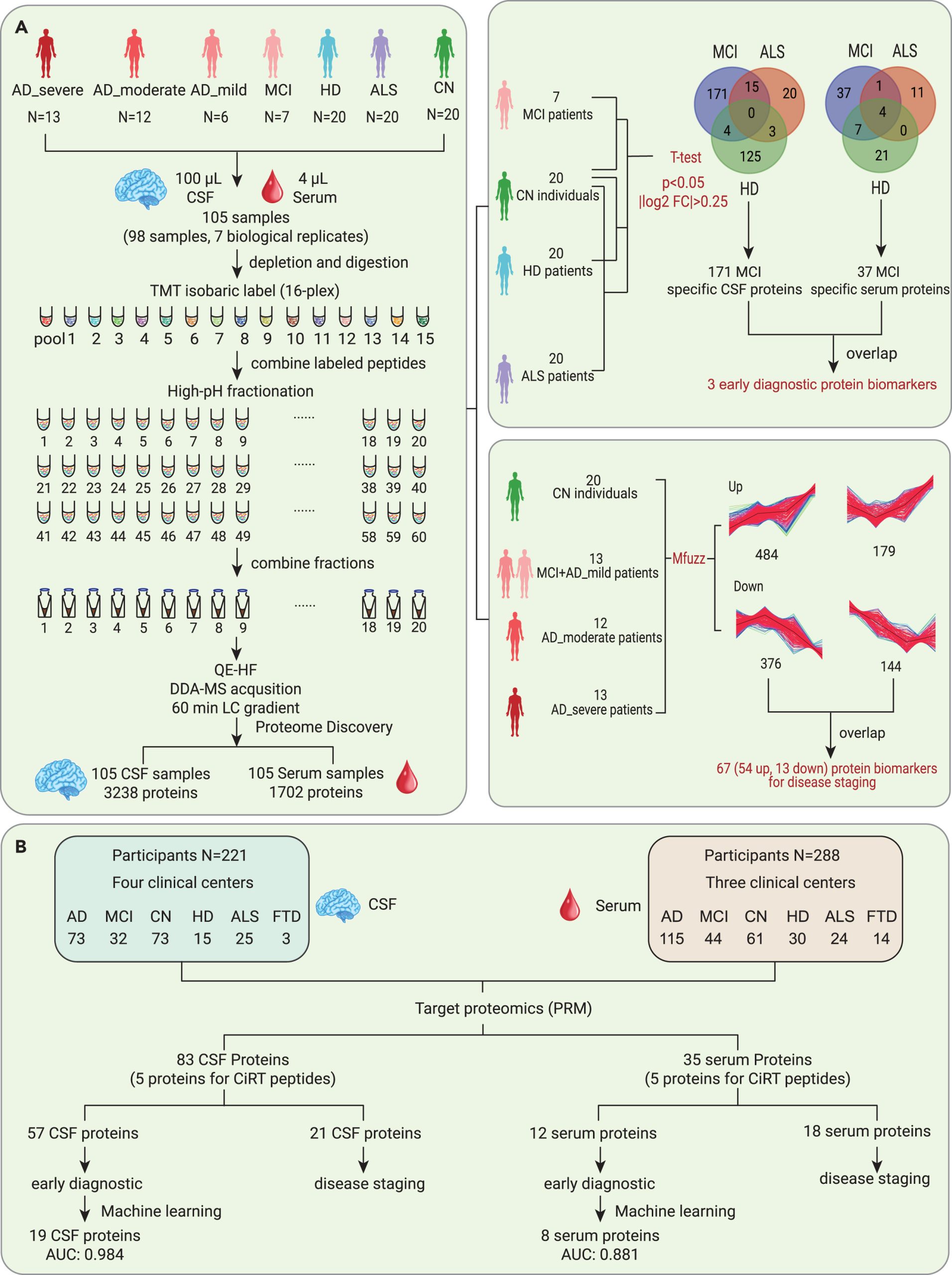
图3 研究人群概述及蛋白组学工作流程示意
结论1:
TMT蛋白组揭示AD导致的MCI蛋白显著改变
为了确定AD的早期CSF诊断标志物,研究团队比较了发现队列中AD和CN参与者的CSF蛋白质组。与CN参与者相比,AD组185个脑脊液蛋白表达水平上调,5个脑脊液蛋白表达水平下调。为了提高生物标志物的特异性,排除了CN和ALS/HD之间的异常调节蛋白质。其余的171个异常调节蛋白质,包括167个上调和4个下调的蛋白质,是MCI的CSF特异性生物标志物,并用于进一步验证。
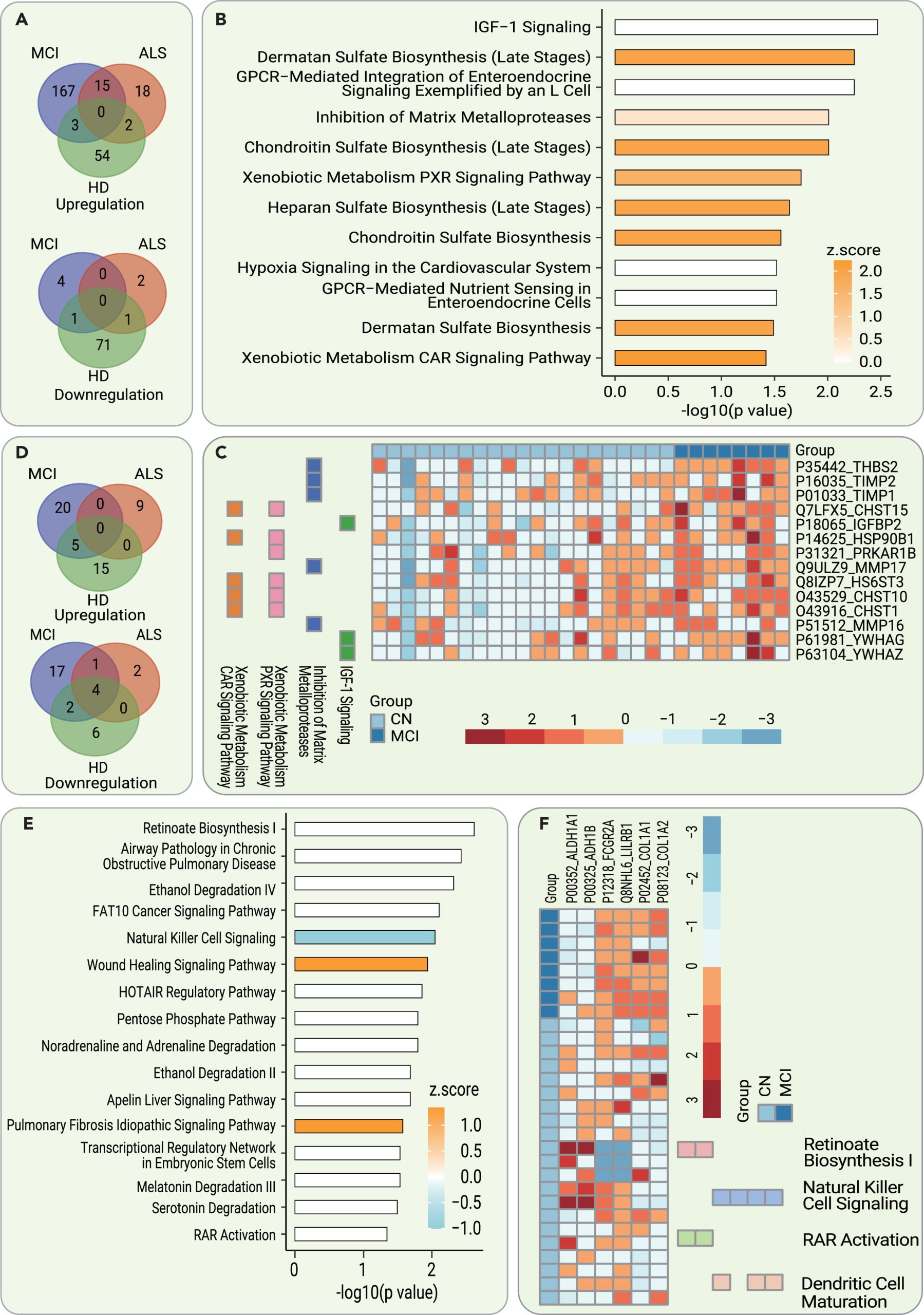
图4 脑脊液和血清蛋白失调及通路在早期AD诊断中的作用
研究人员使用IPA对这190个显著异常调节的CSF蛋白质进行了分析,鉴定了MCI患者的CSF相对于CN参与者发生分子变化的途径,包括IGF-1信号传导、皮肤素硫酸盐生物合成、软骨硫酸盐生物合成、基质金属蛋白酶、外源性代谢/PXR、CAR信号传导途径、肝素硫酸盐生物合成等。这些途径的显著异常调节程度表明了AD病患者CSF中与CN参与者相比的分子变化,包括IGF-1信号传导、皮肤素硫酸盐生物合成和基质金属蛋白酶等。此外,研究团队还发现,这些途径与细胞外基质(ECM)密切相关。
为了确定AD的早期血清诊断生物标志物,研究团队分析了上述参与者的配对血清蛋白组。他们在MCI组和CN组之间鉴定了49个异常调节蛋白质。在排除了与HD和ALS组重叠的异常调节血清蛋白质后,选择了37个潜在的MCI特异性血清生物标志物,用于进一步验证。研究人员使用IPA分析了这49个显著异常调节的蛋白质,以鉴定MCI患者的血清相对于CN参与者发生分子变化的途径。
结论2:
独立队列验证MCI中的差异表达蛋白
为了验证以上蛋白组学分析结果,研究人员在一个独立的多中心队列(含221名脑脊液样本患者和288名血清样本参与者)中进行了基于平行反应监测(PRM)的靶向蛋白质组实验。在AD导致的MCI组中,分别验证了57种CSF蛋白质和12种血清蛋白质的失调。此外,研究还利用 5×FAD小鼠的皮质进行了实时 PCR,选择并验证了2个重要的候选药物(GFAP和GM2A)。
接下来,研究人员利用来自21个AD导致的MCI组和52名正常对照参与者的脑脊液蛋白组学数据构建了一个随机森林机器学习模型,通过机器学习探索失调蛋白的优先级。研究通过模型优化和蛋白挑选,最终构建了一个由19个蛋白质组成的panel可确定为脑脊液早期诊断生物标志物组合,并在9名MCI和21名正常对照参与者的测试集中展现出AUC高达0.984的准确性。此外,该panel组合可有效地区分MCI患者与FTD、ALS和HD患者。
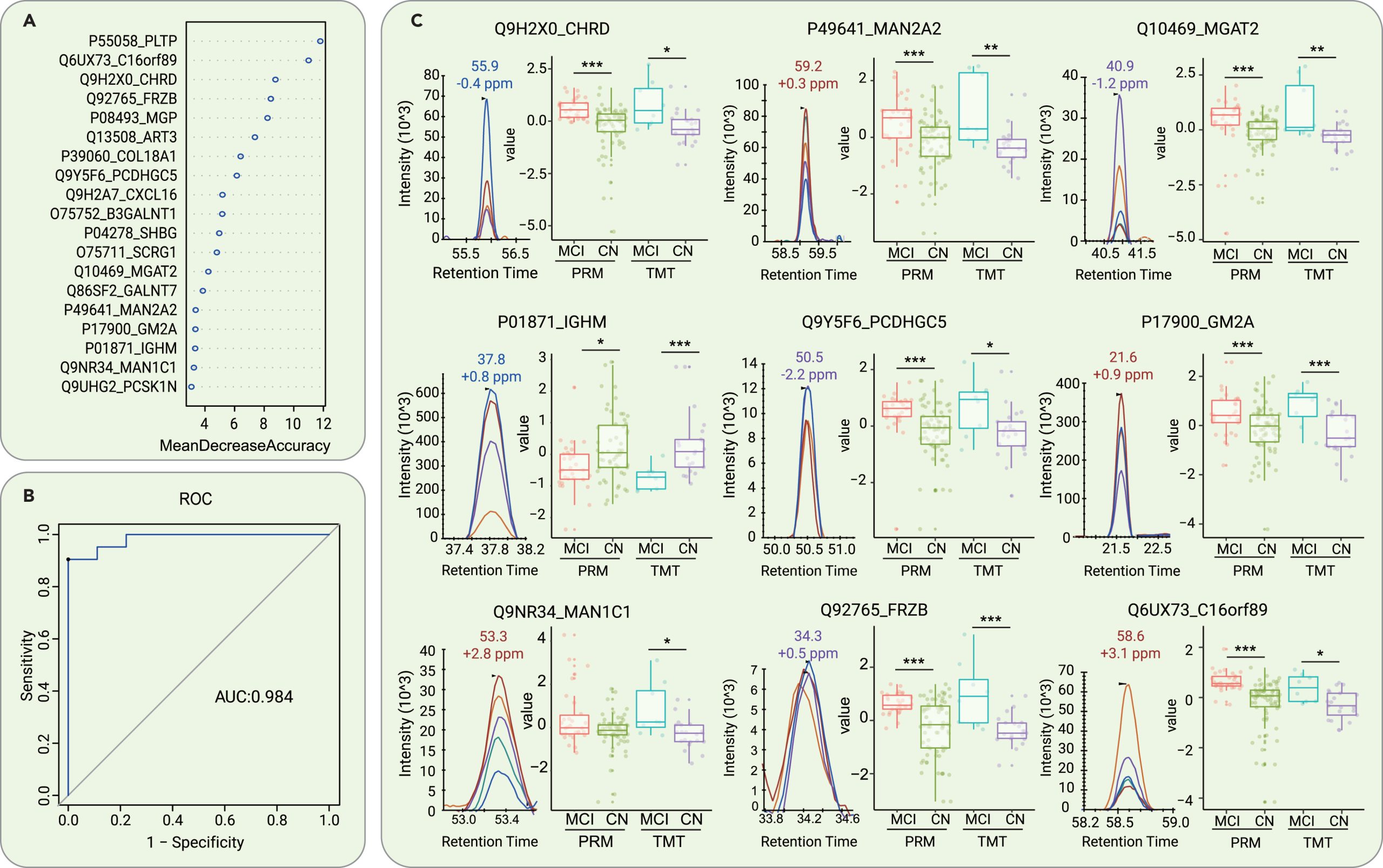
图5 通过对脑脊液蛋白质组学特征的机器学习来区分 AD 和 CN 受试者引起的 MCI
研究发现大多数选定的蛋白质在发现队列和验证队列中表现出相同的表达趋势。19种蛋白质中有4种(MGAT2、GM2A、MAN1C1和MAN2A2)与高尔基体和溶酶体途径有关。已知的是,与上述两者相关的通路在AD、帕金森病和ALS等神经退行性疾病的发病机制中起着关键作用。
研究同时基于23名MCI患者和45名CN参与者血清蛋白质的数据构建随机森林机器学习模型,选定了8种核心蛋白组成的组合panel来区分这两组别。经由8名AD导致的MCI患者和21名CN参与者组成的测试集测试,可实现0.881的AUC准确度。
研究者根据市售单分子免疫检测试剂盒在验证队列子集中检测到的血清GFAP和NEFL水平,结果发现与CN对照组相比,在ALS和FTD患者的血清中发现GFAP和NEFL水平升高。此外,MCI患者表现出GFAP水平升高。使用GFAP、NEFL及其组合鉴别AD导致的MCI患者和对照组,发现血清GFAP的AUC为0.714, NEFL的AUC为0.511,其组合AUC为0.881。
结论3:
配对的脑脊液和血清蛋白质组显示蛋白质在AD进展过程中发生显著改变
为确定AD分期标志物,研究者比较了在AD不同阶段发现的失调蛋白,使用Mfuzz将总共2461个鉴定到的脑脊液蛋白聚类成8个簇,其中簇7和簇8中的蛋白质显示随着疾病进展表现出相同的调控趋势。同样,将1330个从血清中鉴定到的蛋白进行mfuzz聚类,簇5和簇6中的蛋白质显示随着疾病进展表现出相同趋势。
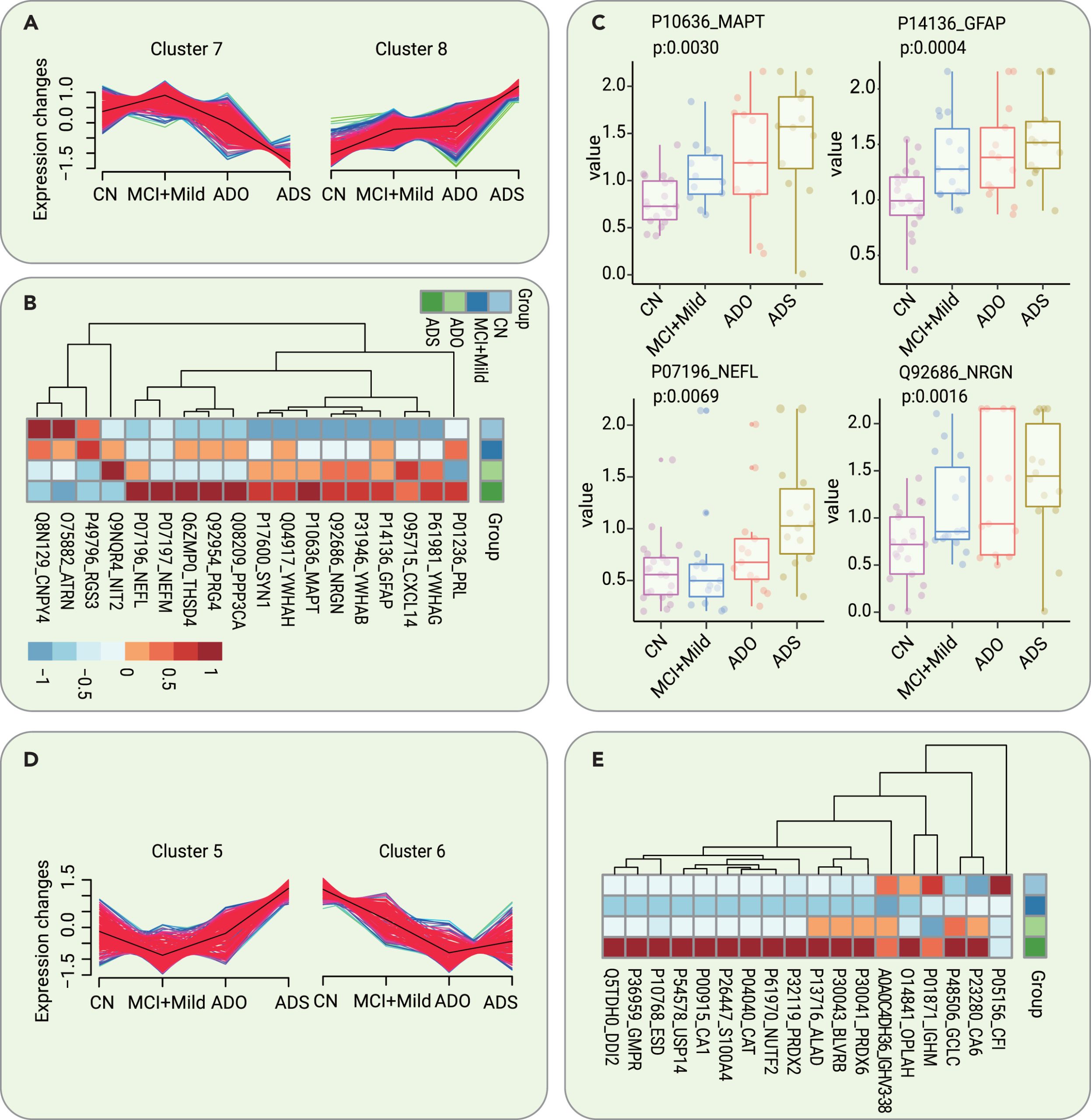
图6 脑脊液和血清蛋白失调作为 AD 分期的潜在生物标志物
结论4:
验证队列中具有AD阶段依赖性失调的蛋白质
研究者在脑脊液样品中共验证了 21 种具有阶段依赖性改变的核心蛋白。其中9种的表达水平随着疾病进展而下调,而其中12种的表达水平上调。值得注意的是,随着疾病的进展,ATRN的表达水平上调。此外,2 种蛋白质YWHAE 和 YWHAG在疾病进展过程中上调,这与近期的研究结果一致。
在血清样本方面,共有 18 种核心蛋白表现出阶段依赖性改变。其中 5 种的水平下调,而其中 13 种的水平随着疾病进展而上调。值得注意的是,CFI在AD进展过程中上调。CFI对于调节补体级联反应至关重要。在AD小鼠模型中发现了补体通路过度激活。此外,在AD发展过程中,发现PRDX2在血清中失调。有趣的是,与在脑脊液中发现的结果类似,另一种YWHAQ被发现在AD的不同阶段在血清中失调。
总 结
总的来说,脑脊液和血清蛋白质组学配对的使用更有利于研究AD中枢和外周环境中蛋白质改变之间的联系。该研究揭示了AD发展过程中多个生物学途径的变化,这有望帮助科学家更好地理解AD的病理机制,为治疗和干预提供新的靶点和策略。该研究为开发更为便捷和准确的阿尔茨海默病早期诊断方法提供了可能性,也为临床实践中的筛查和分期提供了新的工具。
文章链接:
https://www.cell.com/the-innovation/fulltext/S2666-6758(23)00172-8?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS2666675823001728%3Fshowall%3Dtrue









