2022年值得关注的七大技术中,“空间多组学(Spatial multi-omics)”上榜
蛋白质是所有细胞的功能性分子,并且是所有生物过程的效应产物。蛋白质的空间表达对于确定蛋白质在组织中的准确定位和功能至关重要,其可随着细胞类型、细胞周期进展、疾病状态和诊疗方法的变化而改变。因此,空间蛋白质组学可以用来研究疾病相关的蛋白质空间表达谱变化,为寻找生物标志物和开发新的诊疗方法提供全新的视角。近年来,空间蛋白质组学研究在微环境与疾病发展、机制与药物靶点、器官结构异质性和组织器官空间图谱等方面取得了突出的进展。
2022年初,Cell(IF=66.85)上报道了一篇使用空间蛋白组探索乳腺癌疾病病程发展的微环境变化的文章[2]。导管原位癌(DCIS)是一种浸润前病变,通常被认为是浸润性乳腺癌(IBC)的前兆,若不及时治疗,多达一半的患者会在十年内发展为IBC。通过对正常乳腺组织、原发性DCIS、IBC三组进行分区取样研究,根据肌上皮、成纤维细胞和免疫细胞的位置和功能定义了4种不同的肿瘤微环境TME状态的过渡协调,发现在未发生IBC的DCIS患者中,肌上皮破坏更为严重,表明这一过程可以防止复发。本研究详细描绘了乳腺癌病情进展的空间图谱,并强调了TME在调节侵入性转变过程中的重要性。
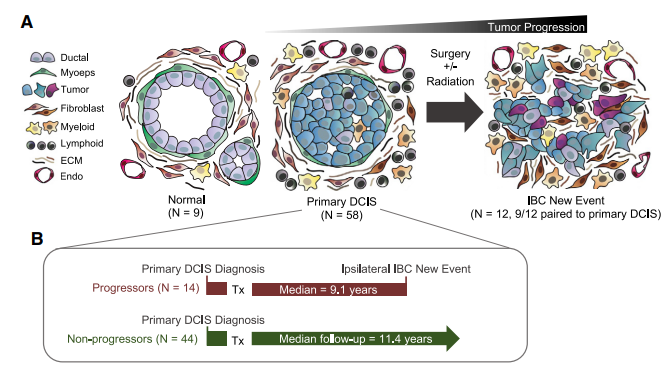
问题探究:乳腺组织的结构、组成和功能如何随着从DCIS到IBC的进展而变化,以及发展为IBC的患者(progressors)与未发展为IBC的患者(non-progressors)的DCIS病变有何区别?
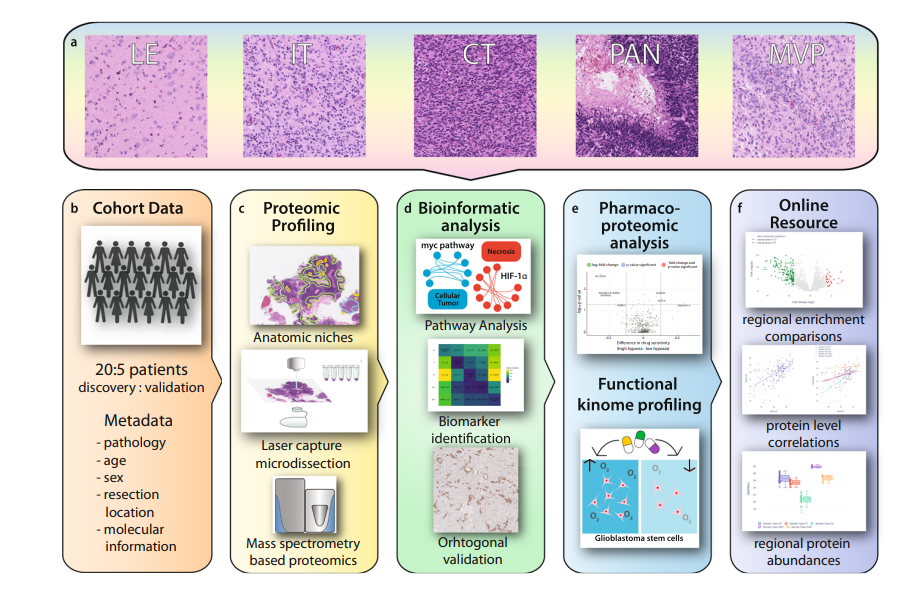
2022年初,Nature Communications(IF=17.694)上报道了另一篇关于胶质母细胞瘤(GBM)的空间蛋白组研究文章[3]。GBM是一种侵袭性脑癌,具有公认的肿瘤内异质性模式,与治疗耐药性和进展有关。研究人员利用质谱法在空间上(86个样本:浸润肿瘤IT、分子肿瘤CT、坏死组织周围栅栏状细胞PAN和微脉管增殖MVP区域,靠近肿瘤前缘LE的相邻组织学正常脑组织)将4794种蛋白质的丰度水平与20名患者的不同组织学模式对齐,并提出在这些区域肿瘤区室内运行的各种分子程序。本研究将蛋白质组学模式叠加到GBM的标志性“空间”组织形态学特征上,以统一的三轴模型捕获肿瘤间和肿瘤内的重要临床相关异质性信息。通过解决相关的空间表型生物学及其在患者肿瘤中的变化,将加速研究者对GBM的生物学机制及其治疗的理解。
2022年6月,蛋白质组学领域大咖,德国马普所Matthias Mann团队在Molecular Cell(IF=19.328)上发表技术综述[4],将目标投向了更前方的下一站站点——单细胞分辨率的“无偏空间蛋白质组学”。鉴于单细胞蛋白组对于组织解离的一些要求和特性,即使是单细胞层面,依旧丢失了非常重要的空间信息。另一方面,RNA在FFPE样品中易于降解并容易与其他生物分子交联,且RNA表达并不能直接预测蛋白质表达,因此蛋白质能更准确反映特定的细胞功能和状态。可通过成像加质谱这一方法来实现“空间”蛋白的检测。空间蛋白组学在临床患者表型分析中,可以用来揭示来自正常或肿瘤FFPE组织切片的天然组织环境中的疾病特异性分子特征,也可生成组织微环境表型图,详细定义组织、基质、剖面、邻域分析的定量蛋白质组图,从而挖掘数据中的空间相关性。
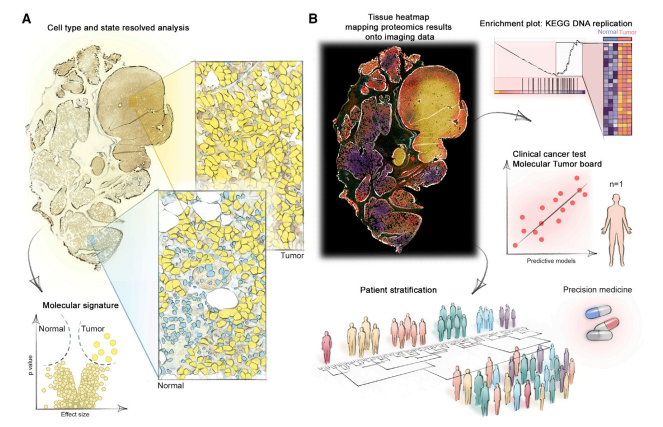
空间蛋白组学的临床应用
2022年8月,Matthias Mann团队又提出进一步深度视觉蛋白组(Deep Visual Proteomics)概念[5],将人工智能驱动的细胞表型图像分析、单细胞或者空间组织获取方法与超高灵敏质谱结合。DVP将蛋白质丰度与复杂的细胞或亚细胞表型联系起来,同时保留住了空间位置。研究者在针对黑色素瘤组织中,DVP可以在黑色素细胞转变为浸润型黑色素瘤时识别空间分辨的蛋白质组变化。
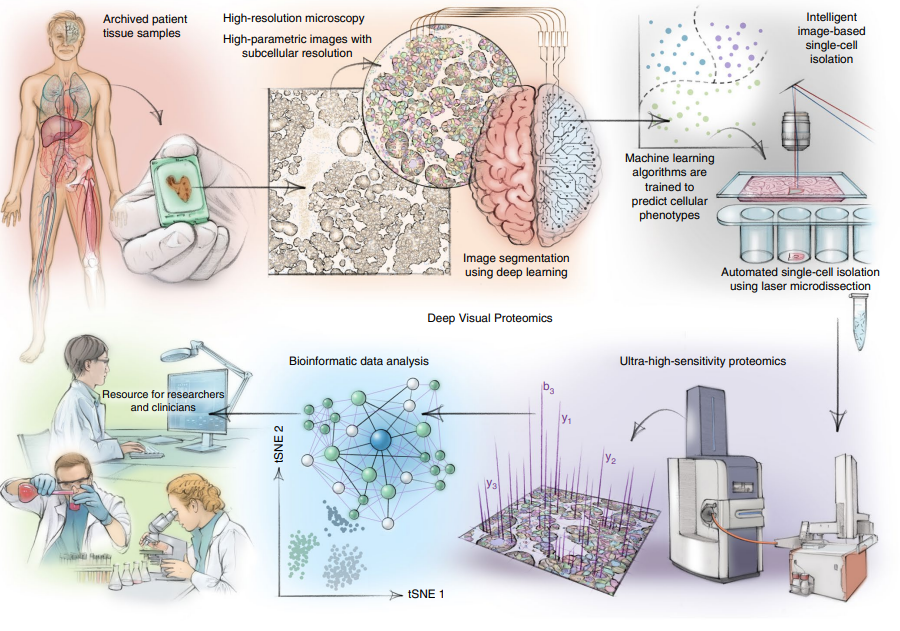
用于空间蛋白组研究的深度视觉蛋白组流程
编译:江燕
审校:刘晶晶
西湖欧米现推出基于膨胀水凝胶的空间蛋白质组学:该技术将组织嵌入可膨胀的水凝胶中,使样本能够在保持原形态的基础上进行放大,从而进行精准物理切割获得准确的空间位置信息,进而结合新一代4D-DIA技术,达到高深度的鉴定水平。
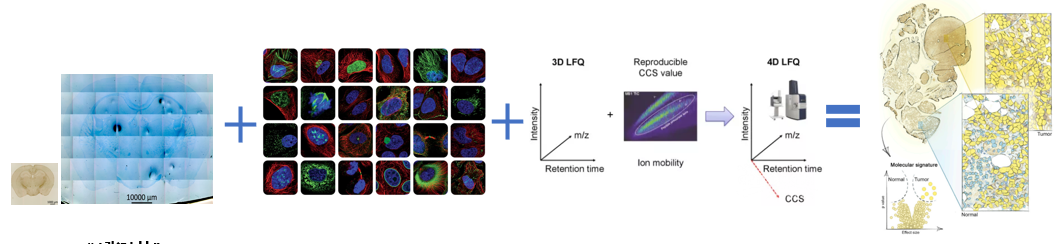
实现组织样本中空间区域的蛋白组特征研究
产品特色:
“1张玻片”:膨胀水凝胶技术,兼容各类组织切片(FFPE、OCT、PFA)和多种染色方法;
“2项技术”:高分辨成像技术精准空间定位 + 新一代4D-DIA质谱平台;
“3大保证”:一对一方案设计,一站式全流程服务,周到售后服务;
“4维领域”:微环境与疾病发展,机制与药物靶点,器官结构异质性,组织器官空间图谱。
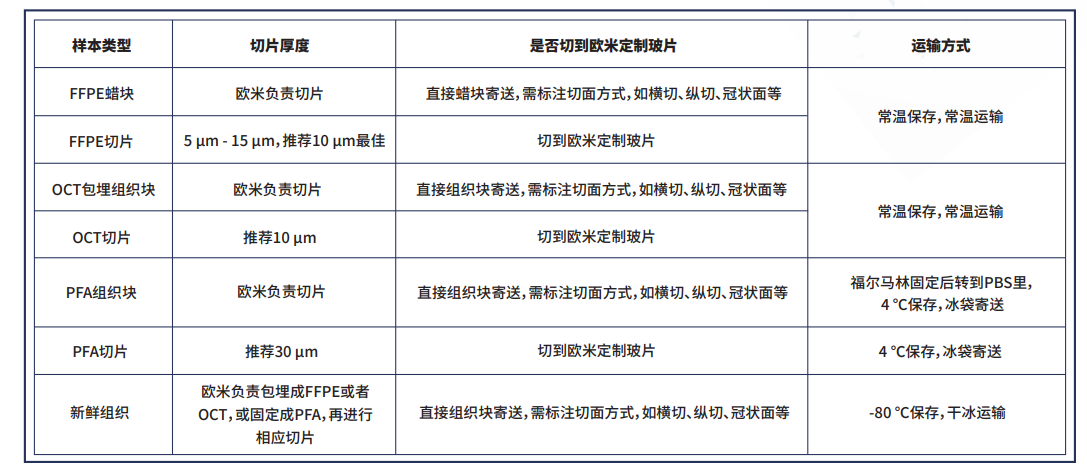
送样建议
参考文献:
1. Eisenstein M. Seven technologies to watch in 2022 [J]. Nature. 2022;601(7894):658-661.
2. Risom T, Glass DR, Averbukh I, et al. Transition to invasive breast cancer is associated with progressive changes in the structure and composition of tumor stroma [J]. Cell. 2022; 185(2):299-310.e18.
3. Lam KHB, Leon AJ, Hui W, et al. Topographic mapping of the glioblastoma proteome reveals a triple-axis model of intra-tumoral heterogeneity [J]. Nature Communications. 2022;13(1):116.
4. Mund A, Brunner AD, Mann M. Unbiased spatial proteomics with single-cell resolution in tissues [J]. Mol Cell. 2022;82(12):2335-2349.
5. Mund A, Coscia F, Kriston A, et al. Deep Visual Proteomics defines single-cell identity and heterogeneity [J]. Nat Biotechnol. 2022;40(8):1231-1240.



2022年值得关注的七大技术中,“空间多组学(Spatial multi-omics)”上榜
蛋白质是所有细胞的功能性分子,并且是所有生物过程的效应产物。蛋白质的空间表达对于确定蛋白质在组织中的准确定位和功能至关重要,其可随着细胞类型、细胞周期进展、疾病状态和诊疗方法的变化而改变。因此,空间蛋白质组学可以用来研究疾病相关的蛋白质空间表达谱变化,为寻找生物标志物和开发新的诊疗方法提供全新的视角。近年来,空间蛋白质组学研究在微环境与疾病发展、机制与药物靶点、器官结构异质性和组织器官空间图谱等方面取得了突出的进展。
2022年初,Cell(IF=66.85)上报道了一篇使用空间蛋白组探索乳腺癌疾病病程发展的微环境变化的文章[2]。导管原位癌(DCIS)是一种浸润前病变,通常被认为是浸润性乳腺癌(IBC)的前兆,若不及时治疗,多达一半的患者会在十年内发展为IBC。通过对正常乳腺组织、原发性DCIS、IBC三组进行分区取样研究,根据肌上皮、成纤维细胞和免疫细胞的位置和功能定义了4种不同的肿瘤微环境TME状态的过渡协调,发现在未发生IBC的DCIS患者中,肌上皮破坏更为严重,表明这一过程可以防止复发。本研究详细描绘了乳腺癌病情进展的空间图谱,并强调了TME在调节侵入性转变过程中的重要性。

问题探究:乳腺组织的结构、组成和功能如何随着从DCIS到IBC的进展而变化,以及发展为IBC的患者(progressors)与未发展为IBC的患者(non-progressors)的DCIS病变有何区别?
2022年初,Nature Communications(IF=17.694)上报道了另一篇关于胶质母细胞瘤(GBM)的空间蛋白组研究文章[3]。GBM是一种侵袭性脑癌,具有公认的肿瘤内异质性模式,与治疗耐药性和进展有关。研究人员利用质谱法在空间上(86个样本:浸润肿瘤IT、分子肿瘤CT、坏死组织周围栅栏状细胞PAN和微脉管增殖MVP区域,靠近肿瘤前缘LE的相邻组织学正常脑组织)将4794种蛋白质的丰度水平与20名患者的不同组织学模式对齐,并提出在这些区域肿瘤区室内运行的各种分子程序。本研究将蛋白质组学模式叠加到GBM的标志性“空间”组织形态学特征上,以统一的三轴模型捕获肿瘤间和肿瘤内的重要临床相关异质性信息。通过解决相关的空间表型生物学及其在患者肿瘤中的变化,将加速研究者对GBM的生物学机制及其治疗的理解。
2022年6月,蛋白质组学领域大咖,德国马普所Matthias Mann团队在Molecular Cell(IF=19.328)上发表技术综述[4],将目标投向了更前方的下一站站点——单细胞分辨率的“无偏空间蛋白质组学”。鉴于单细胞蛋白组对于组织解离的一些要求和特性,即使是单细胞层面,依旧丢失了非常重要的空间信息。另一方面,RNA在FFPE样品中易于降解并容易与其他生物分子交联,且RNA表达并不能直接预测蛋白质表达,因此蛋白质能更准确反映特定的细胞功能和状态。可通过成像加质谱这一方法来实现“空间”蛋白的检测。空间蛋白组学在临床患者表型分析中,可以用来揭示来自正常或肿瘤FFPE组织切片的天然组织环境中的疾病特异性分子特征,也可生成组织微环境表型图,详细定义组织、基质、剖面、邻域分析的定量蛋白质组图,从而挖掘数据中的空间相关性。

空间蛋白组学的临床应用
2022年8月,Matthias Mann团队又提出进一步深度视觉蛋白组(Deep Visual Proteomics)概念[5],将人工智能驱动的细胞表型图像分析、单细胞或者空间组织获取方法与超高灵敏质谱结合。DVP将蛋白质丰度与复杂的细胞或亚细胞表型联系起来,同时保留住了空间位置。研究者在针对黑色素瘤组织中,DVP可以在黑色素细胞转变为浸润型黑色素瘤时识别空间分辨的蛋白质组变化。

用于空间蛋白组研究的深度视觉蛋白组流程
编译:江燕
审校:刘晶晶
西湖欧米现推出基于膨胀水凝胶的空间蛋白质组学:该技术将组织嵌入可膨胀的水凝胶中,使样本能够在保持原形态的基础上进行放大,从而进行精准物理切割获得准确的空间位置信息,进而结合新一代4D-DIA技术,达到高深度的鉴定水平。

实现组织样本中空间区域的蛋白组特征研究
产品特色:
“1张玻片”:膨胀水凝胶技术,兼容各类组织切片(FFPE、OCT、PFA)和多种染色方法;
“2项技术”:高分辨成像技术精准空间定位 + 新一代4D-DIA质谱平台;
“3大保证”:一对一方案设计,一站式全流程服务,周到售后服务;
“4维领域”:微环境与疾病发展,机制与药物靶点,器官结构异质性,组织器官空间图谱。

送样建议
参考文献:
1. Eisenstein M. Seven technologies to watch in 2022 [J]. Nature. 2022;601(7894):658-661.
2. Risom T, Glass DR, Averbukh I, et al. Transition to invasive breast cancer is associated with progressive changes in the structure and composition of tumor stroma [J]. Cell. 2022; 185(2):299-310.e18.
3. Lam KHB, Leon AJ, Hui W, et al. Topographic mapping of the glioblastoma proteome reveals a triple-axis model of intra-tumoral heterogeneity [J]. Nature Communications. 2022;13(1):116.
4. Mund A, Brunner AD, Mann M. Unbiased spatial proteomics with single-cell resolution in tissues [J]. Mol Cell. 2022;82(12):2335-2349.
5. Mund A, Coscia F, Kriston A, et al. Deep Visual Proteomics defines single-cell identity and heterogeneity [J]. Nat Biotechnol. 2022;40(8):1231-1240.