♦ 研究背景及简介
血栓的结构和组成被认为是影响r-tPA(重组组织型纤溶酶原活性成分)溶栓和机械取栓效果的关键因素。组织学研究表明,血栓一般可分为两种类型的组织组成:富含纤维蛋白和血小板聚集的硬组织和富含红细胞的软组织。然而,关于人血栓中硬组织和软组织分子异质性知之甚少。虽然有少数研究对某些血管疾病中血栓的蛋白质组学进行了研究,但他们分析的是没有根据其软硬空间结构细分的大块血栓的蛋白质组学。
2023年4月13日,暨南大学第一附属医院临床神经科学研究所徐安定/逯丹/曾智军教授团队在著名杂志Stroke上发表题为 “Spatial Proteomics Analysis of Soft and Stiff Regions in Human Acute Arterial Thrombus” 的研究性论文。研究采用基于激光捕获显微切割技术的空间蛋白质组学研究策略,对从心肌或脑梗死患者收集的2种动脉血栓的硬组织和软组织进行空间解剖,旨在寻找促进动脉溶栓的潜在新治疗靶点。
结果证明了人动脉血栓硬组织和软组织蛋白质的空间不同组成,血栓的软组织域相比坚硬的部分往往更容易受到r-tPA介导的溶栓作用,也更容易通过血栓切除术去除,并表明 TGF-β1是促进动脉血栓溶解的关键治疗靶点。

♦ 研究样本
(1)研究队列和样本:心肌梗死患者12例,脑梗死患者13例。其中7例心肌梗死患者的冠状动脉血栓和11例脑梗死患者的颈动脉血栓进行空间蛋白质组学分析。2例脑梗死患者和5例心肌梗死患者的剩余血栓采用免疫组织化学染色进行验证。
(2)组学方法:空间蛋白质组学(西湖欧米提供检测和分析服务)、免疫组织化学染色。
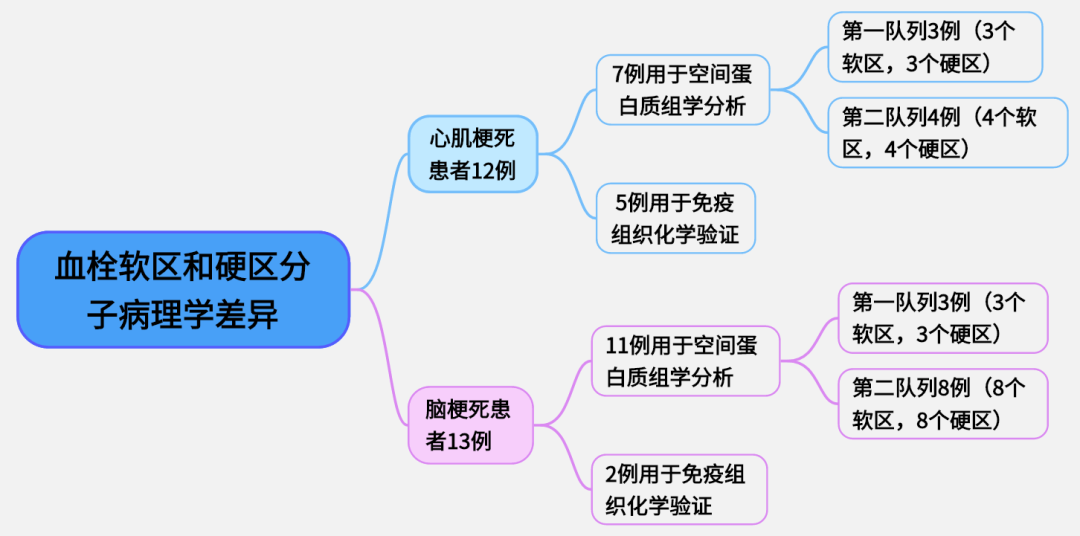
图1 研究队列
♦ 研究结果
◊ TGF-β1在动脉血栓形成中的作用
血栓的异质性组成对溶栓治疗效果产生了重要影响,其中包括纤维蛋白和血小板聚集形成的硬区域和富含红细胞的软区域。
本研究首先采用激光捕获显微切割技术对急性心肌梗死患者是冠状动脉血栓中的硬组织(富含纤维蛋白的区域)和软组织(缺乏纤维蛋白的区域)进行空间和特异性切割,如图2A所示;为了提高蛋白质组学分析的统计能力,作者进行了2个独立的队列研究,并比较了来自第一队列(3名患者)和来自第二队列(4名患者)的冠状动脉血栓中的差异蛋白(p值小于0.05且FC大于1.3)。
发现了7种共同的差异蛋白,包括4个上调蛋白(MTHFD1、TGF-β1、H1-3和COL1A1)和3个下调蛋白(APCS、PROS1和ATP5F1D )(图2B);鉴于TGF-β1是显著上调蛋白之一,且与纤维化密切相关,作者进一步验证了TGF-β1在冠状动脉血栓中的表达。
免疫荧光染色显示成纤维细胞(Vimentin+)中TGF-β1阳性细胞的比例高于总细胞数(图2C)。通过建立FeCl3诱导的小鼠血栓模型发现TGF-β1抑制剂给药后的平均首次凝血时间明显长于生理盐水对照组(412秒vs 151秒)。此外,TGF-β1抑制剂处理组最终血管闭塞的平均时间比生理盐水对照组长270秒(图2D,E)。
为了研究TGF-β1在更具有临床相关性的情况下的作用,作者在血栓形成后用TGF-β1抑制剂联合r-tPA治疗小鼠。与单独使用r-tPA治疗相比,r-tPA联合TGF-β1抑制剂治疗导致血流量显著增加(图2F)。
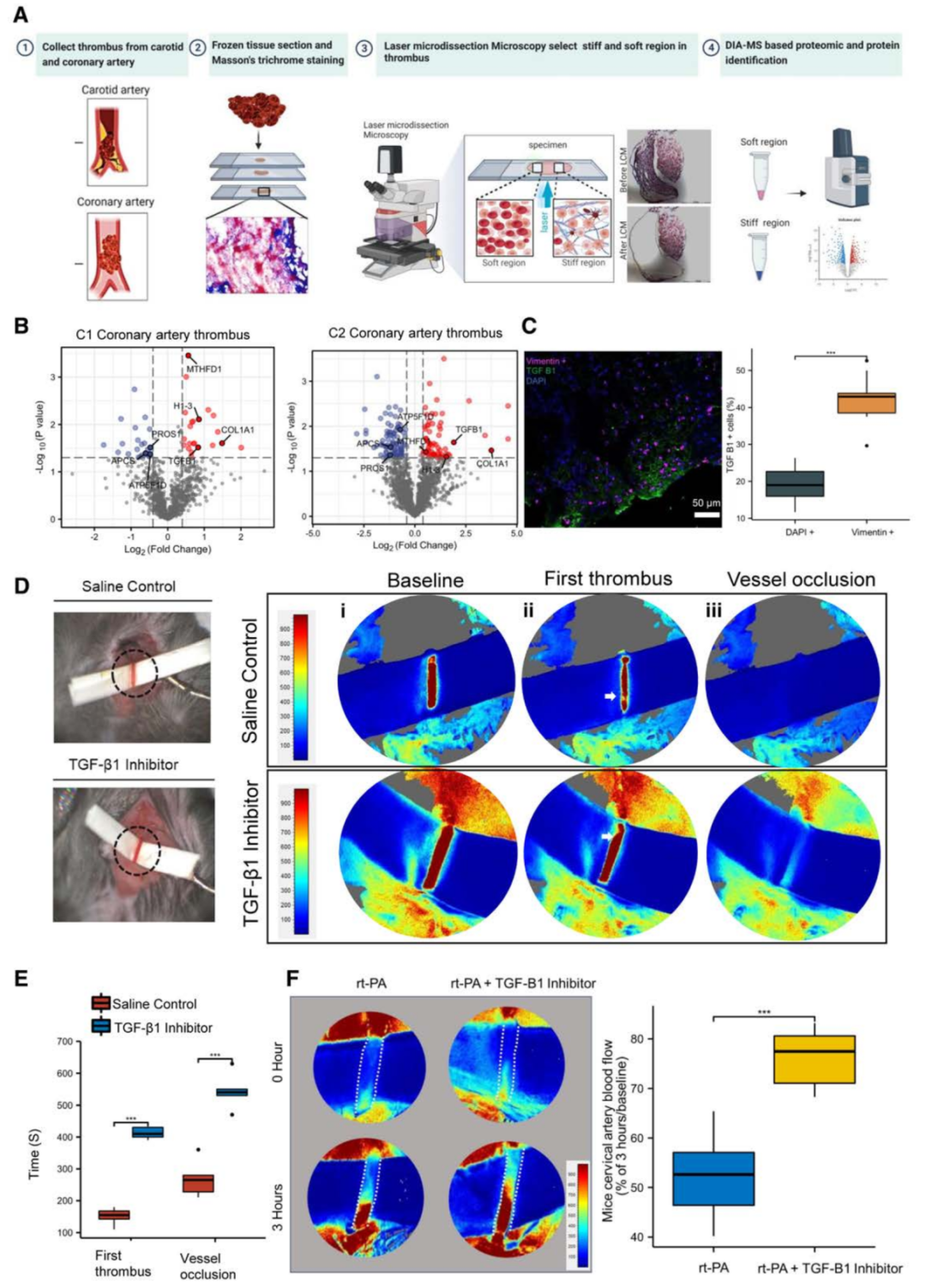
图2 空间蛋白质组学分析冠状动脉衍生血栓在硬组织与软组织比较的特征
◊ 血小板是释放TGF-β1的主要成分
为了进一步扩大研究范围,作者又对11例脑梗死患者劲动脉血栓样品进行空间蛋白质组学分析,对两个队列的两种动脉源性血栓中的差异蛋白进行GO富集分析,发现在5个相同的GO 富集。
有趣的是,它们与血小板活化、细胞质囊泡和管腔以及细胞释放机制有关。
这与之前的研究一致,即血小板是血栓硬化区在激活过程中释放TGF-β1的主要成分。
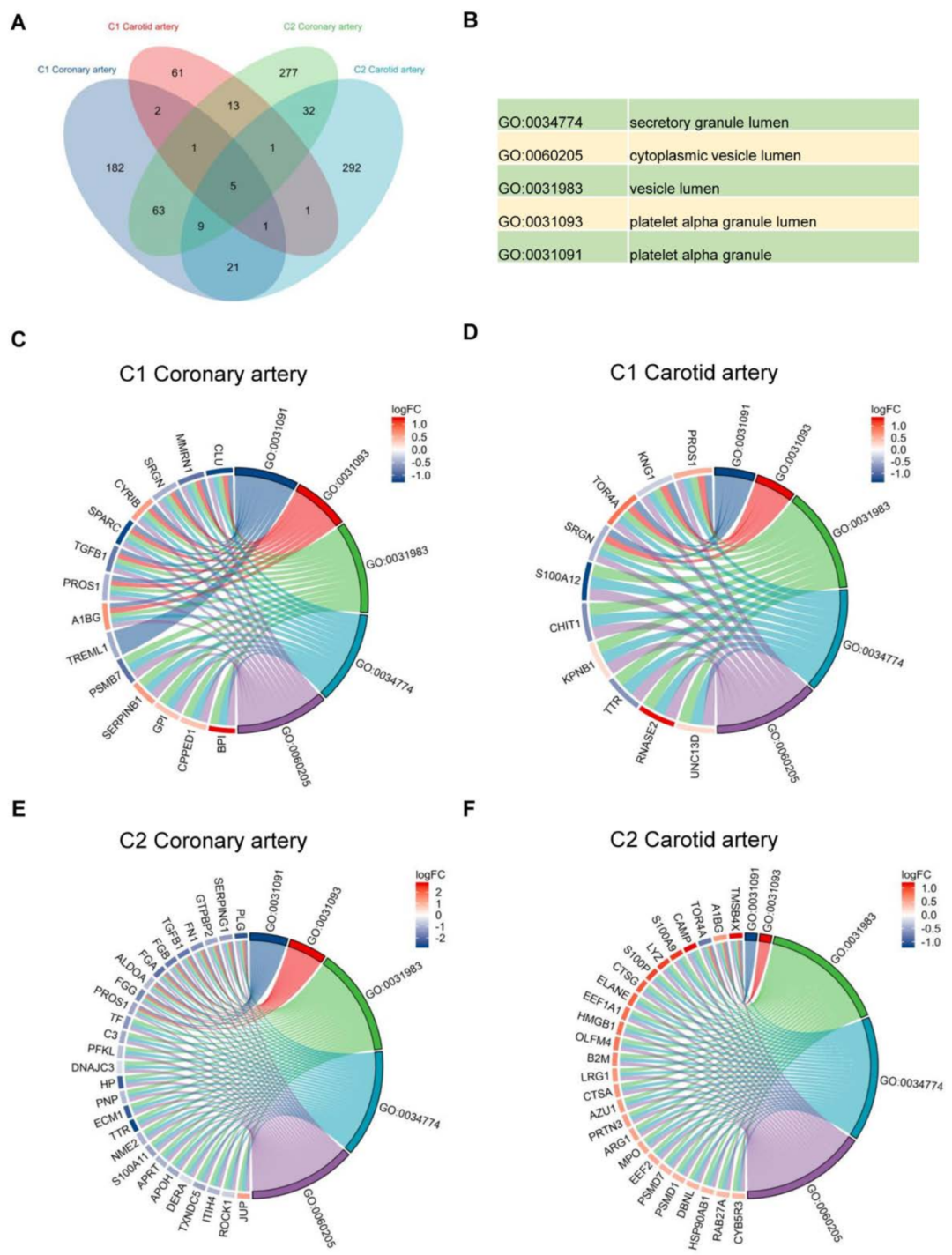
图3 颈动脉和冠状动脉衍生血栓的成对空间蛋白质组学分析揭示特征基因和途径
◊ TGF-β刺激COL1A1的表达
除了TGF-β1外,还发现COL1A1是两个队列中颈动脉和冠状动脉血栓共有的另一个显著的失调蛋白(图4A和4B)。据报道TGF-β可以刺激小鼠胆管细胞COL1A1的表达,在第一个队列中,COL1A1在硬血栓区比软血栓区平均表达增加1.7倍(图4C),而在第二个队列中,COL1A1平均表达增加2.3倍(图4D)。
此外,我们通过免疫荧光染色证实COL1A1蛋白在患者动脉血栓的僵硬组织表达(图4E)。最后,我们进行SMA免疫荧光染色以可视化标记血管壁的平滑肌细胞,并验证COL1A1在小鼠颈动脉内腔的血栓中组装(图4F)。
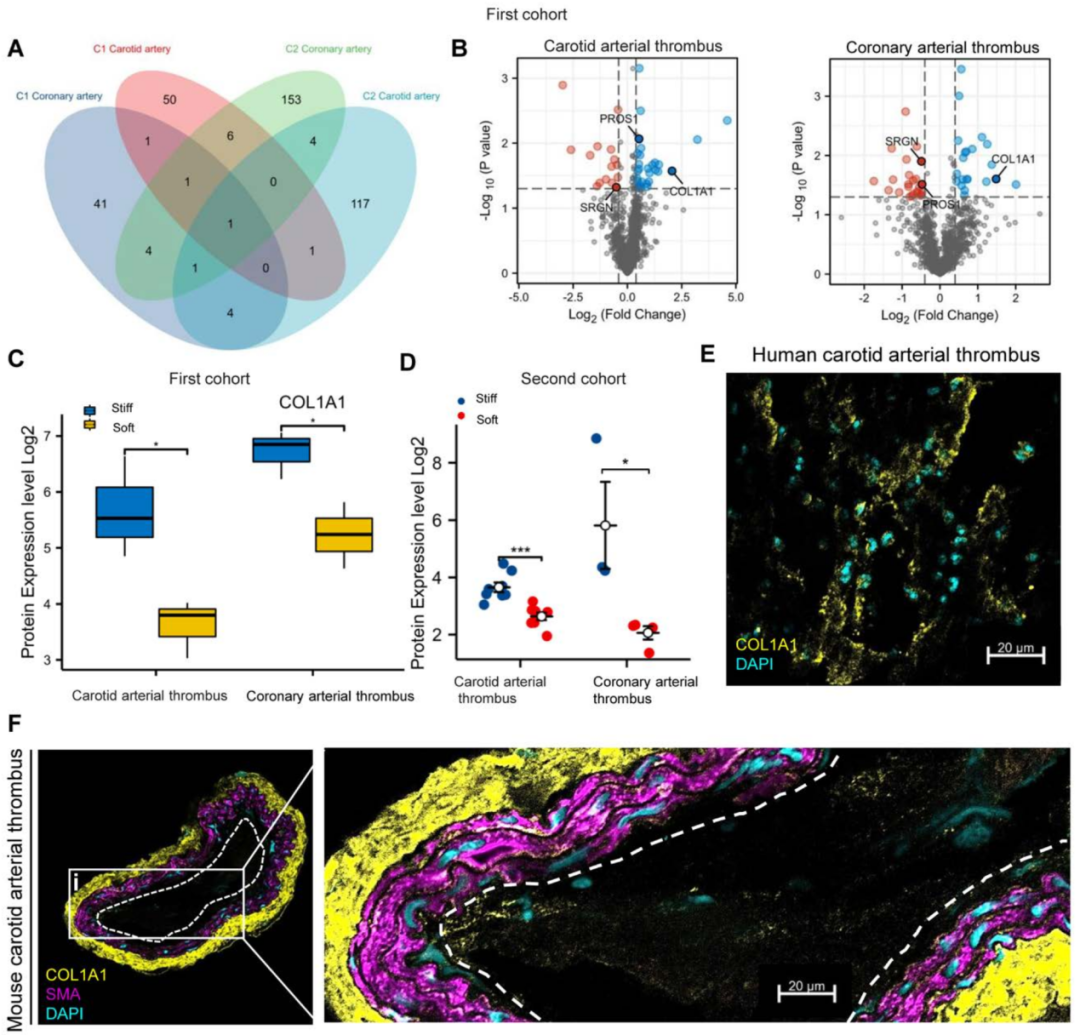
图4 空间蛋白质组学揭示了颈动脉和冠状动脉血栓中常见的上调蛋白
♦ 文章小结
本研究利用动脉血栓软组织和硬组织的空间差异蛋白质组学分析,为人类血栓活检中富含纤维蛋白的硬组织和富含红细胞的软组织分子景观提供了新的视角。在r-tPA存在的情况下,抑制TGF-β1可显著延长血栓形成时间,促进血流恢复。
此外,作者发现与软组织相比,COL1A1在冠状动脉和劲动脉血栓的硬组织中表达上调。
这些观察结果表明,TGF-β1是减缓急性动脉血栓硬化过程的潜在有希望的治疗靶点。
此外,治疗性抑制TGF-β1和COL1A1是否会延长急性缺血性脑卒中的时间窗,在未来的研究中值得关注。
文章链接:https://www.ahajournals.org/doi/10.1161/STROKEAHA.123.042486
编译:Joanna
审核:Leslie
♦ 研究背景及简介
血栓的结构和组成被认为是影响r-tPA(重组组织型纤溶酶原活性成分)溶栓和机械取栓效果的关键因素。组织学研究表明,血栓一般可分为两种类型的组织组成:富含纤维蛋白和血小板聚集的硬组织和富含红细胞的软组织。然而,关于人血栓中硬组织和软组织分子异质性知之甚少。虽然有少数研究对某些血管疾病中血栓的蛋白质组学进行了研究,但他们分析的是没有根据其软硬空间结构细分的大块血栓的蛋白质组学。
2023年4月13日,暨南大学第一附属医院临床神经科学研究所徐安定/逯丹/曾智军教授团队在著名杂志Stroke上发表题为 “Spatial Proteomics Analysis of Soft and Stiff Regions in Human Acute Arterial Thrombus” 的研究性论文。研究采用基于激光捕获显微切割技术的空间蛋白质组学研究策略,对从心肌或脑梗死患者收集的2种动脉血栓的硬组织和软组织进行空间解剖,旨在寻找促进动脉溶栓的潜在新治疗靶点。
结果证明了人动脉血栓硬组织和软组织蛋白质的空间不同组成,血栓的软组织域相比坚硬的部分往往更容易受到r-tPA介导的溶栓作用,也更容易通过血栓切除术去除,并表明 TGF-β1是促进动脉血栓溶解的关键治疗靶点。

♦ 研究样本
(1)研究队列和样本:心肌梗死患者12例,脑梗死患者13例。其中7例心肌梗死患者的冠状动脉血栓和11例脑梗死患者的颈动脉血栓进行空间蛋白质组学分析。2例脑梗死患者和5例心肌梗死患者的剩余血栓采用免疫组织化学染色进行验证。
(2)组学方法:空间蛋白质组学(西湖欧米提供检测和分析服务)、免疫组织化学染色。

图1 研究队列
♦ 研究结果
◊ TGF-β1在动脉血栓形成中的作用
血栓的异质性组成对溶栓治疗效果产生了重要影响,其中包括纤维蛋白和血小板聚集形成的硬区域和富含红细胞的软区域。
本研究首先采用激光捕获显微切割技术对急性心肌梗死患者是冠状动脉血栓中的硬组织(富含纤维蛋白的区域)和软组织(缺乏纤维蛋白的区域)进行空间和特异性切割,如图2A所示;为了提高蛋白质组学分析的统计能力,作者进行了2个独立的队列研究,并比较了来自第一队列(3名患者)和来自第二队列(4名患者)的冠状动脉血栓中的差异蛋白(p值小于0.05且FC大于1.3)。
发现了7种共同的差异蛋白,包括4个上调蛋白(MTHFD1、TGF-β1、H1-3和COL1A1)和3个下调蛋白(APCS、PROS1和ATP5F1D )(图2B);鉴于TGF-β1是显著上调蛋白之一,且与纤维化密切相关,作者进一步验证了TGF-β1在冠状动脉血栓中的表达。
免疫荧光染色显示成纤维细胞(Vimentin+)中TGF-β1阳性细胞的比例高于总细胞数(图2C)。通过建立FeCl3诱导的小鼠血栓模型发现TGF-β1抑制剂给药后的平均首次凝血时间明显长于生理盐水对照组(412秒vs 151秒)。此外,TGF-β1抑制剂处理组最终血管闭塞的平均时间比生理盐水对照组长270秒(图2D,E)。
为了研究TGF-β1在更具有临床相关性的情况下的作用,作者在血栓形成后用TGF-β1抑制剂联合r-tPA治疗小鼠。与单独使用r-tPA治疗相比,r-tPA联合TGF-β1抑制剂治疗导致血流量显著增加(图2F)。

图2 空间蛋白质组学分析冠状动脉衍生血栓在硬组织与软组织比较的特征
◊ 血小板是释放TGF-β1的主要成分
为了进一步扩大研究范围,作者又对11例脑梗死患者劲动脉血栓样品进行空间蛋白质组学分析,对两个队列的两种动脉源性血栓中的差异蛋白进行GO富集分析,发现在5个相同的GO 富集。
有趣的是,它们与血小板活化、细胞质囊泡和管腔以及细胞释放机制有关。
这与之前的研究一致,即血小板是血栓硬化区在激活过程中释放TGF-β1的主要成分。

图3 颈动脉和冠状动脉衍生血栓的成对空间蛋白质组学分析揭示特征基因和途径
◊ TGF-β刺激COL1A1的表达
除了TGF-β1外,还发现COL1A1是两个队列中颈动脉和冠状动脉血栓共有的另一个显著的失调蛋白(图4A和4B)。据报道TGF-β可以刺激小鼠胆管细胞COL1A1的表达,在第一个队列中,COL1A1在硬血栓区比软血栓区平均表达增加1.7倍(图4C),而在第二个队列中,COL1A1平均表达增加2.3倍(图4D)。
此外,我们通过免疫荧光染色证实COL1A1蛋白在患者动脉血栓的僵硬组织表达(图4E)。最后,我们进行SMA免疫荧光染色以可视化标记血管壁的平滑肌细胞,并验证COL1A1在小鼠颈动脉内腔的血栓中组装(图4F)。

图4 空间蛋白质组学揭示了颈动脉和冠状动脉血栓中常见的上调蛋白
♦ 文章小结
本研究利用动脉血栓软组织和硬组织的空间差异蛋白质组学分析,为人类血栓活检中富含纤维蛋白的硬组织和富含红细胞的软组织分子景观提供了新的视角。在r-tPA存在的情况下,抑制TGF-β1可显著延长血栓形成时间,促进血流恢复。
此外,作者发现与软组织相比,COL1A1在冠状动脉和劲动脉血栓的硬组织中表达上调。
这些观察结果表明,TGF-β1是减缓急性动脉血栓硬化过程的潜在有希望的治疗靶点。
此外,治疗性抑制TGF-β1和COL1A1是否会延长急性缺血性脑卒中的时间窗,在未来的研究中值得关注。
文章链接:https://www.ahajournals.org/doi/10.1161/STROKEAHA.123.042486
编译:Joanna
审核:Leslie









