研究背景及简介
抗肿瘤免疫疗法已经开启了癌症治疗的新时代,但原发性肝细胞癌(hepatocellular carcinoma,HCC)患者对免疫检查点阻断(ICB)的客观缓解率仅为15%。逃避ICB在HCC中的主要原因是多样的体细胞突变引起的复杂肿瘤免疫微环境(TIME),这突显了研究HCC体细胞突变与TIME之间内在关联的紧迫性,以提高免疫治疗的疗效。
CTNNB1基因突变在20%-39%的HCC中被观察到。CTNNB1基因增强功能(CTNNB1GOF)突变导致免疫抑制的TIME,其特征是T细胞排斥、树突状细胞(DCs)招募缺陷和趋化因子的再表达。CTNNB1GOF HCC降低了免疫治疗的疗效,被称为 “冷” 肿瘤。重新将 “冷” 肿瘤转变为 “热” 肿瘤是为CTNNB1GOF HCC患者提供新的治疗选择的重要问题。
基质金属蛋白酶9(MMP9)是一种锌依赖性内肽酶,能够降解明胶和胶原,实现组织重塑,促进肿瘤侵袭、转移和血管生成。高水平的MMP9与多种癌症类型的不良预后有关。然而,MMP9在HCC中调节TIME的机制仍需要进一步解读。
近日,华中科技大学同济医学院附属同济医院张万广、丁则阳团队联合复旦大学附属华山医院陈进宏团队,共同在 BMJ 子刊 Gut(IF=24.5)发表题为 Targeting MMP9 in CTNNB1 mutant hepatocellular carcinoma restores CD8 T cell-mediated antitumour immunity and improves anti-PD-1 efficacy 的文章。西湖欧米为该项目提供TMT蛋白质组学服务。

图1 文章论文
文章揭示了MMP9在CTNNB1突变型肝细胞癌中的关键作用,特别是通过调控免疫微环境和影响CD8+ T细胞的活性。研究人员提出MMP9可能是一个潜在的治疗靶点,并且其阻断可能提高PD-1抗体疗法的疗效。
研究样本
人HCC活检组织,小鼠HCC组织,HEK 293T细胞系,Hepa1-6细胞系,小鼠原代CD8 T细胞等
研究方法
流式细胞术,转录组学,单细胞测序,TMT蛋白质组学,FACS,Elisa等
研究结果
1. MMP9在CTNNB1GOF HCC 中上调
通过建立CTNNB1GOF背景下的3种HCC模型(使用活化的 AKT/β-catenin、c-Met/β-catenin 和 c-Myc/β-catenin 质粒通过尾静脉注射到小鼠体内),细胞核中β-连环蛋白的积累表明 Wnt/β-catenin 通路激活。使用流式细胞术和t-SNE分析免疫微环境,发现在CTNNB1GOF HCC中,巨噬细胞和髓样抑制细胞的浸润增加,而树突状细胞、CD8+ T和CD4+ T细胞减少。
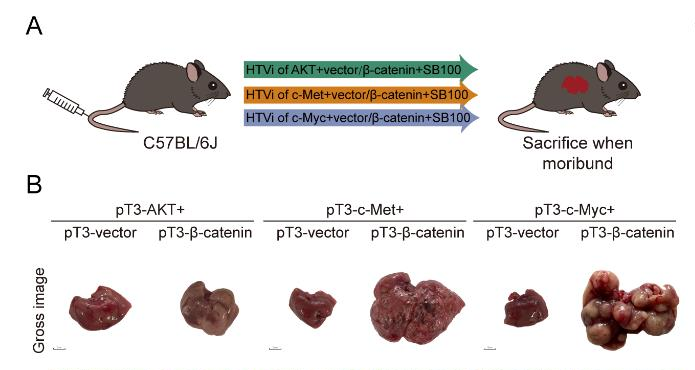
图2 3种HCC模型构建
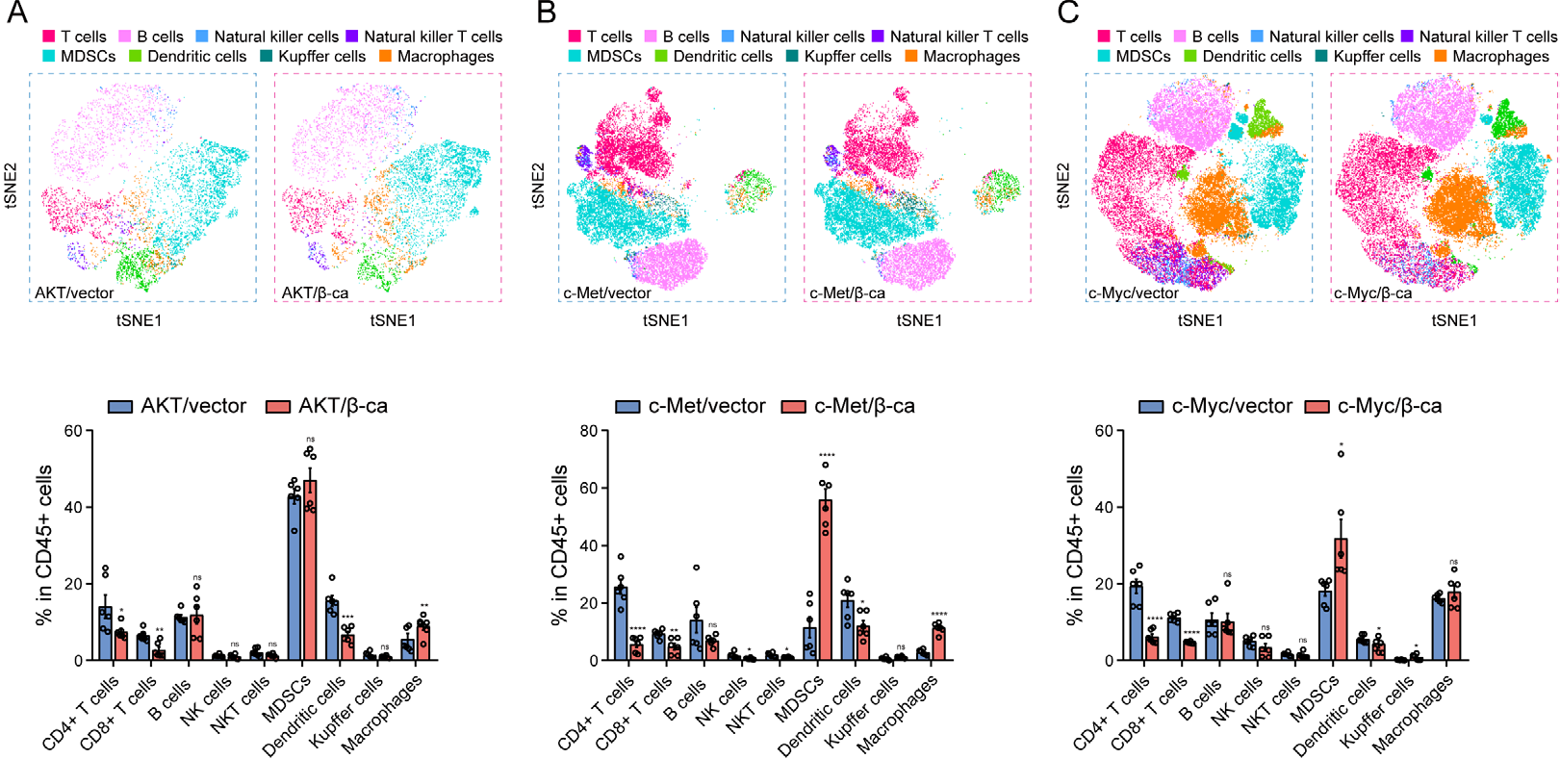
图3 3种模型中关键免疫细胞组成区别
转录组分析发现3个上调基因分别为MMP9、PROCR和ZFP287。为确定与免疫调节和不良预后相关的核心基因,研究人员使用PPI网络和TCGA数据集中的单因素COX回归分析了ImmuneScore和StromalScore筛选的差异表达基因,鉴定到5个基因分别为CXCL5、MMP9、PLAUR、CLEC5A和ITGB6。上述2个基因集的交叉决定了MMP9是重塑HCC肿瘤免疫微环境的CTNNB1GOF 的驱动基因。研究也进一步验证了MMP9在CTNNB1GOF 肿瘤中高度表达。
为进一步验证CTNNB1对MMP9的调节作用,分别用激动剂和抑制剂证明了 Wnt/β-catenin 通路以时间和浓度依赖性调控MMP9。
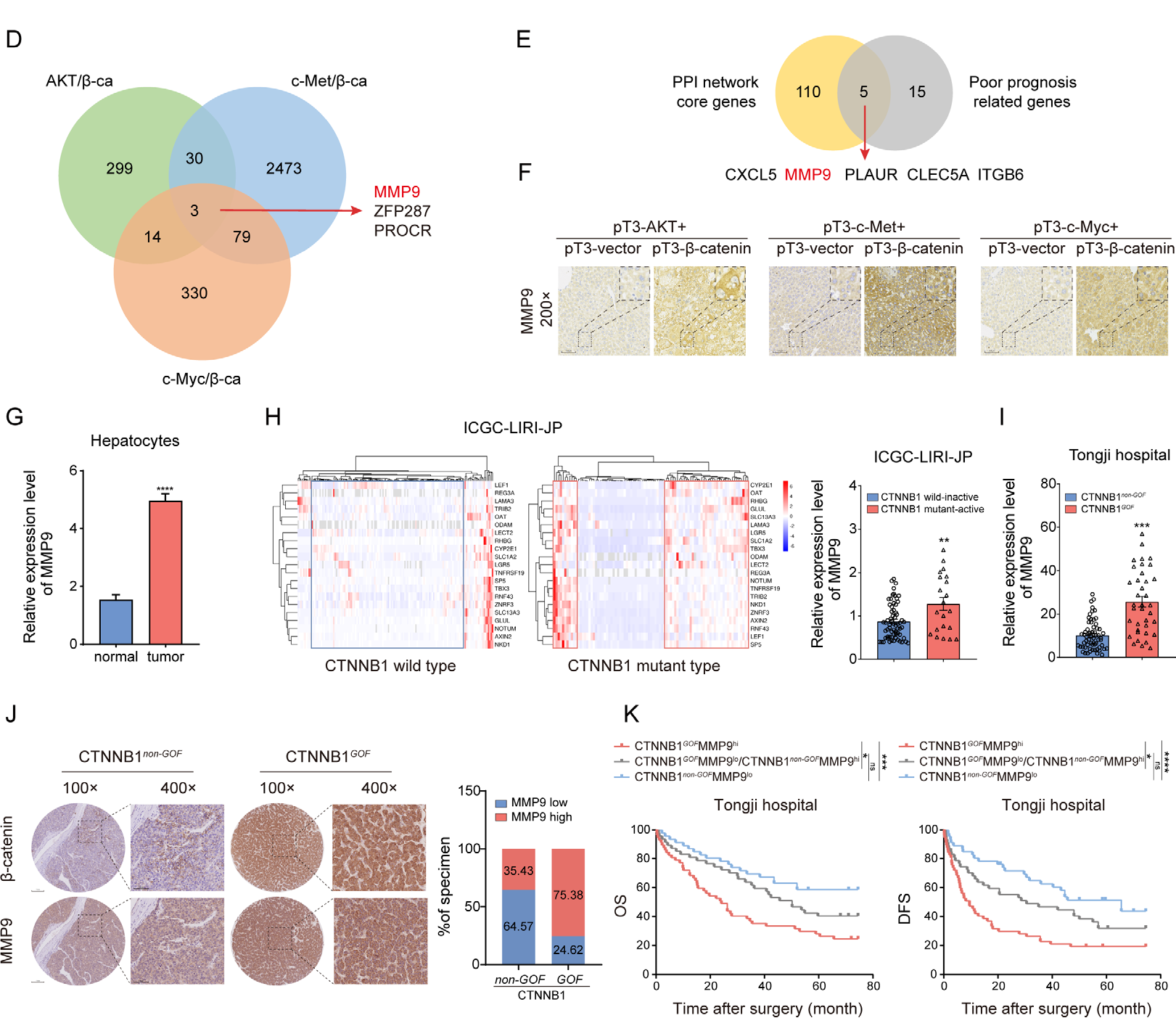
图4 MMP9在CTNNB1GOF 肿瘤中高度表达
2. MMP9通过诱导抑制性肿瘤微环境(TIME)促进HCC的发展
GESA显示在TCGA-LIHC数据集中,MMP9表达与抑制性肿瘤微环境相关。实验证明,MMP9对体外肿瘤增殖和裸鼠模型中的肿瘤体积几乎没有影响;但在免疫完全的C57小鼠模型中,MMP9的敲除显著减小了肿瘤体积和质量。
使用经MMP9下调处理的Hepa1-6细胞构建C57 HCC模型,证明其能显著抑制肿瘤生长并延长小鼠生存期。FCM分析显示,MMP9敲除导致T细胞数量的增加、巨噬细胞减少,并且CD8+ T细胞表现出增强的细胞毒性。这些结果表明MMP9通过诱导抑制性TIME促进HCC的进展。
3. MMP9抑制CD8+ T细胞的活化和迁移
研究者进一步通过消除CD4+ T细胞、CD8+ T细胞或巨噬细胞进一步鉴定受MMP9调节的特定免疫细胞亚群。研究发现抑制CD8+ T细胞是MMP9促进肿瘤进展不可缺少的。体外共培养研究表明,CD8+ T细胞的肿瘤细胞毒性在MMP9刺激下以剂量依赖性方式减弱。Elisa测定显示,MMP9抑制颗粒酶B(granzyme B)、IFN-γ和TNFα的分泌。总的来说,MMP9阻碍了CD8+ T细胞的活化和迁移,从而导致抑制性肿瘤免疫微环境。
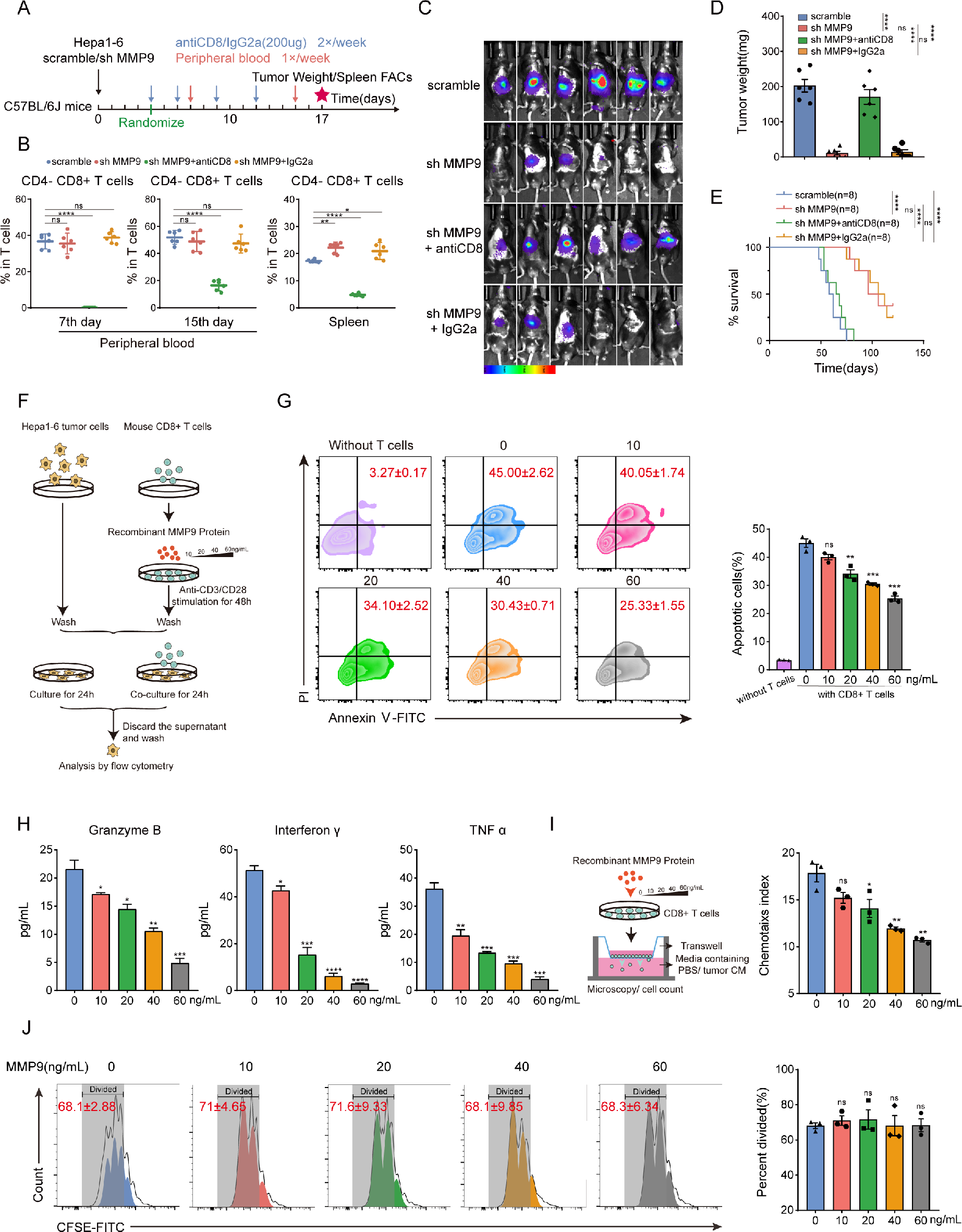
图5 MMP9抑制CD8+ T细胞的活化和迁移
4. MMP9的阻断改善CTNNB1GOF 的免疫微环境并增强抗PD-1疗效
为评估MMP9阻断对CTNNB1GOF HCC中抗PD-1疗效的影响,研究人员使用MMP9肝细胞条件性敲除小鼠(MMP9F/F; MMP9-Alb-cre,以下简称MMP9Δhep)构建了带有CTNNB1GOF 的自发性肿瘤模型。在肿瘤形成后,一部分小鼠接受抗PD-1抗体治疗。与其他组相比,接受抗PD-1抗体治疗的MMP9Δhep小鼠 CD8+ T细胞显著增加,显示出显著的肿瘤抑制和延长生存期的能力,且CD8 T细胞中颗粒酶B和IFN-γ升高表明CTLs的毒性增强。
此外,与MMP-9-in-1(MMP9的特异性抑制剂)或抗PD-1单药疗法相比,MMP-9-in-1与抗PD-1联合治疗产生了更显著的肿瘤消退和生存期延长。FCM分析表明,联合治疗增强了CD8 T细胞的浸润和细胞毒性。这些结果表明,MMP9阻断具有重塑CTNNB1GOF HCC的TIME潜力,并使抗PD-1治疗敏感。
5. β-catenin介导的SIRT2抑制通过促进β-catenin/KDM4D复合物的形成上调MMP9
研究人员进一步探索了β-catenin调控MMP9的确切机制。研究人员发现XAV939促进KDM4D表达并抑制SIRT2表达。CoIp结果验证了β-连环蛋白与KDM4D或SIRT2的结合。免疫荧光证实β-catenin与KDM4D或SIRT2在Hepa1-6细胞的细胞质和细胞核中共定位。
基于上述观察,研究人员假设SIRT2和KDM4D可能与β-catenin竞争性结合,而共免疫沉淀(CoIP)结果验证了SIRT2的过表达显著抑制了β-catenin和KDM4D的结合。KDM4D敲低或SIRT2过表达诱导的MMP9蛋白下调在 laduviglusib 的刺激下被逆转。此外,KDM4D敲低或SIRT2过表达抑制MMP9的表达并赋予TIME激活,从而抑制肿瘤形成。上述结果表明,β-catenin对SIRT2的抑制促进了 β-catenin/KDM4D 复合物的形成,从而通过上调MMP9促进抑制TIME。
6. MMP9抑制CD8+ CXCR3+ T细胞的浸润
研究人员进行了scRNA-seq以探索MMP9在重塑免疫微环境中的机制。采用荧光激活细胞分选(FACS)从MMP9F/F 和 MMP9Δhep 小鼠的CTNNB1GOF HCC组织中分离肿瘤CD45+ 细胞。无监督的UMAP分析确定了23个亚簇,包括T细胞、髓样细胞、NK细胞、B细胞、DC和中性粒细胞。MMP9敲除后,T细胞的浸润水平显著增加。
在确定MMP9以CD8+ T细胞依赖性方式促进HCC中的作用后,研究者进行了对CD8+ T细胞的无监督聚类分析,揭示了六个不同的CD8+ T细胞亚型,特别是CD8 CXCR3亚型在MMP9Δhep 样本中显著增加。研究人员还进一步研究了CD8+ CXCR3+ T细胞的动态免疫状态,发现MMP9敲除主要影响CD8+ CXCR3+ T细胞的浸润和功能。这一结果通过多重免疫荧光染色法得到了支持,证实了在MMP9Δhep 样本中CD8+ CXCR3+ T细胞的富集。
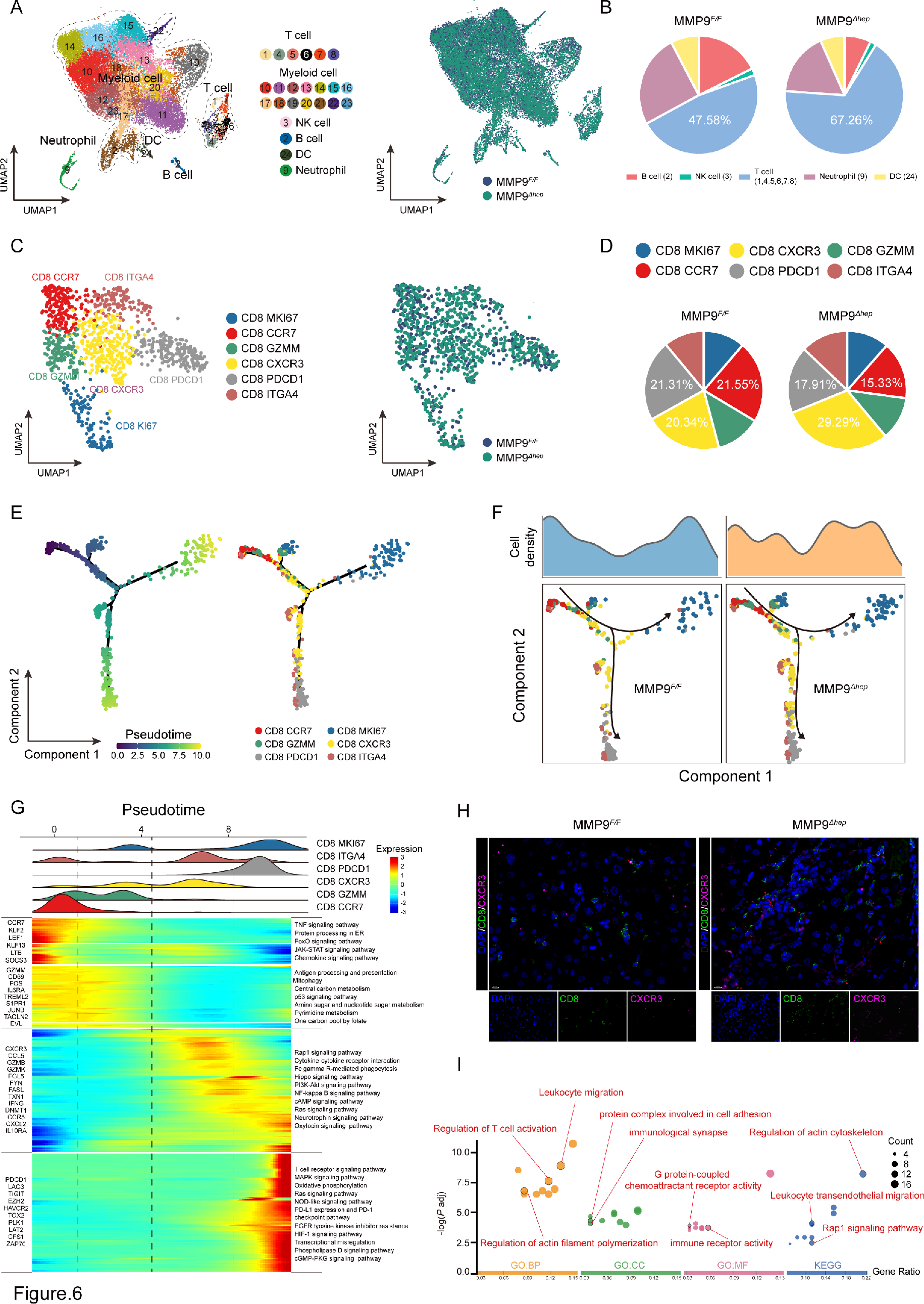
图6 MMP9抑制CD8+ CXCR3+ T细胞的浸润
7. MMP9降解CD8+ T细胞表面SSH1,从而抑制CXCR3介导的GPCR的细胞内信号传导
研究人员进一步阐明了MMP9在调控CD8+ CXCR3+ T细胞中的机制。使用TMT蛋白质组学方法鉴定了MMP9刺激后CD8+ T细胞中26个蛋白的下调,这些蛋白质富集于GTP酶活性、GDP磷酸酶活性、调节细胞质钙离子浓度和细胞迁移等功能。GSEA分析进一步表明MMP9刺激与多种膜转运过程相关联。类似地,MMP9抑制了CD8+ T细胞中CXCR3介导的ERK和AKT的磷酸化,提示MMP9抑制了CXCR3介导的GPCR细胞内信号转导。
此外,在MMP9刺激下,CD8+ T细胞的F-actin在细胞边缘分散,而未刺激MMP9的T细胞中在前缘积聚。以上数据表明,MMP9抑制了CXCR3介导的GPCR细胞内信号转导。研究人员发现MMP9降解了CD8+ T细胞表面的SSH1,SSH1与CXCR3结合,但在MMP9介导的SSH1裂解中分离。在CD8+ T细胞中敲除SSH1抑制了CXCL10诱导的ERK和AKT的磷酸化,并阻碍了CD8+ T细胞的活化、迁移和极化。此外,SSH1的上调消除了MMP9诱导的对CD8+ T细胞迁移和活化的抑制。
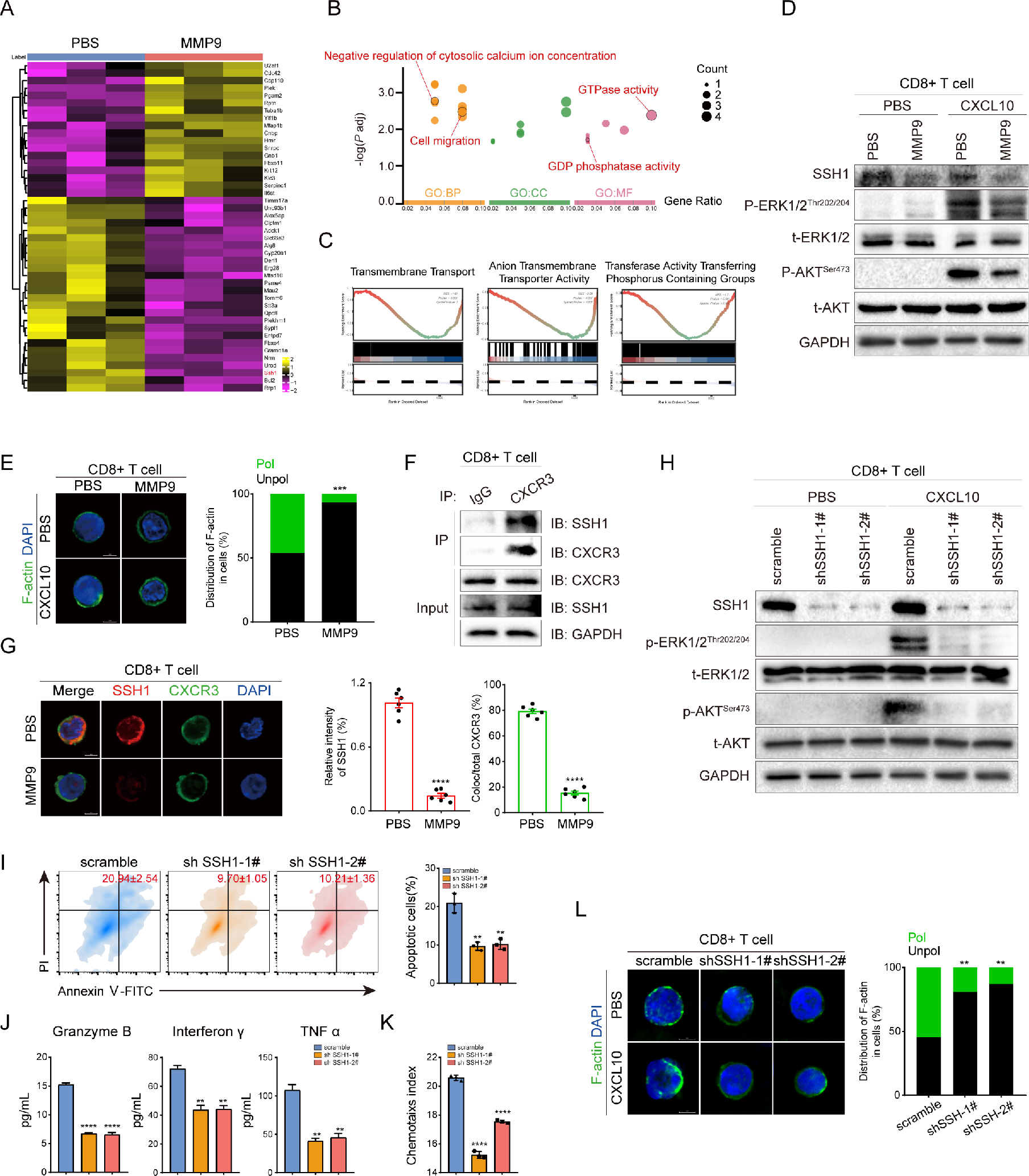
图7 MMP9抑制CXCR3介导的GPCR细胞信号
8. MMP9为HCC中的免疫治疗提供了有价值的治疗靶点和生物标志物
研究人员开发了一种新的抗MMP9兔单克隆抗体(anti-MMP9 rabbit mAb),并评估了其在临床实践中的潜在治疗价值。anti-PD-1 或 anti-MMP9 单独治疗在一定程度上抑制了肿瘤生长,而联合治疗则更显著地抑制了肿瘤生长并延长了生存期。研究结果显示了抗MMP9 mAb的治疗价值,且 anti-MMP9 和 anti-PD-1 的联合治疗可能是HCC免疫治疗的有前途的策略。
在临床上,通过对在同济医院获得的HCC患者样本的分析,研究人员发现MMP9的高表达与β-catenin和KDM4D呈正相关,与SIRT2呈负相关。此外,高水平的MMP9与 CD8+CXCR3+ T细胞的浸润减少和CD8+ T细胞的细胞毒性减弱相关,同时高MMP9表达的患者更容易在手术后复发。
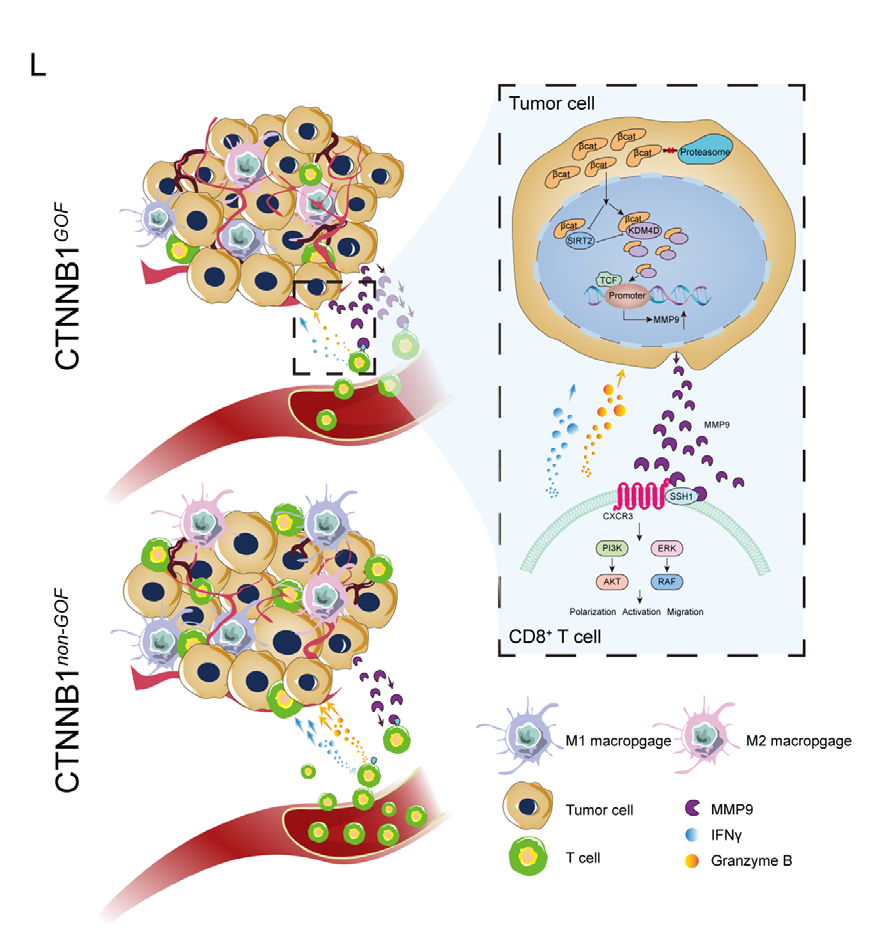
图8 MMP9在CTNNB1GOF HCC患者中诱导的肿瘤免疫微环境示意图
文章小结
文章最后提到,尽管MMP9的抗体在其他研究中已经显示出有利的安全性和临床疗效,但在HCC中的效果尚未报告。作者鼓励在未来的临床试验中验证抗MMP9 mAb在HCC中的疗效。文章还指出,在这一过程中需要关注对肝纤维化的影响。
总体来说,这项研究揭示了CTNNB1GOF HCC中MMP9的关键作用,为通过调控MMP9来改善抗PD-1疗法的疗效提供了新的思路。
文章链接:
https://gut.bmj.com/content/early/2023/12/12/gutjnl-2023-331342