7月31日,西湖大学医学院郭天南团队,联合浙江省肿瘤医院郑智国、朱笕青,浙江大学华跃进团队,在 Nature Communications 上发表了卵巢癌蛋白组学新研究 Proteomic landscape of epithelial ovarian cancer,提供了上皮性卵巢癌的多病理类型蛋白质组学全景图,为改进诊断和治疗策略提供了新的见解。
西湖欧米负责该研究的部分生信分析和靶向蛋白质组工作。西湖欧米生信数据总监葛伟刚、质谱部资深技术员詹越城参与本次研究。

图1 论文截图
- 提纲挈领 -
文章通过对来自中国813名不同病理类型及治疗方案患者的卵巢组织及部分配对的血浆样本的蛋白质组学分析,共定量10,715种蛋白质,鉴定了2551种与上皮性卵巢癌(EOC)恶性程度相关的蛋白质,其中8种分泌性蛋白在血浆中被验证,可能作为潜在的良恶性鉴别的生物标志物。本研究也系统性地分析了五种常见EOC病理亚型间的显著差异蛋白质,挖掘病理变化背后的分子水平差异。此外,该研究在术前采集血浆和手术切除组织中分别鉴定了与预后相关的多个蛋白质,通过具有临床转化价值的靶向蛋白质组组学(MRM)验证了他们的预后价值,并基于此建立了基于蛋白质特征的机器学习模型,用于预测辅助化疗后一年内复发风险,在国内外独立队列中验证了该模型的有效性。
结果1:
中国EOC蛋白质组图谱
研究人员收集了来自三个临床队列的753例EOC手术切除组织样本,分别为:原发队列中接受初次减瘤手术的PDS-EOC(N=555)、接受新辅助化疗的NACT-EOC(N=74)、复发队列RLP-EOC(N=124)。
PDS-EOC队列包括五种组织学亚型:高级别浆液性(HGSOC, 80.2%)、低级别浆液性(LGSOC, 3.4%)、透明细胞(CCOC, 6.8%)、子宫内膜样(ECOC, 7.0%)和黏液性(MCOC, 2.5%)。研究还纳入了108例正常、良性和交界性卵巢组织作为对照。
研究人员使用PulseDIA对861例患者的1114个卵巢组织样本进行了蛋白质组学分析(最终通过质量控制的样本为1041个),共定量了10,527种高置信度的蛋白质,且批次效应可忽略不计,定量可重复性高。
癌症组织中鉴定的蛋白质显著多于非癌症组织,且通过全蛋白质组学数据的无监督聚类分析,正常组织和癌症组织能够很好地区分开来。
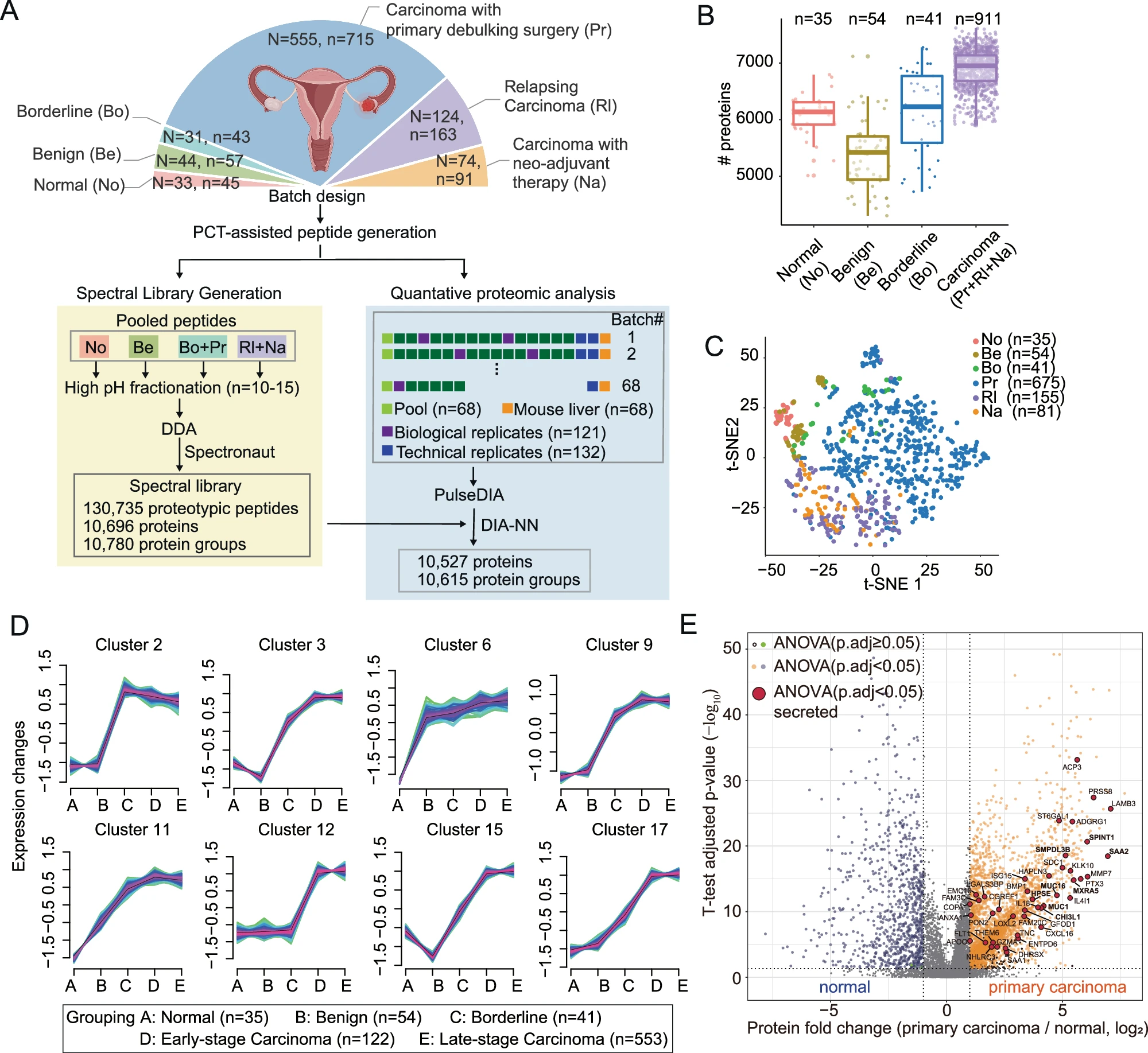
图2 中国EOC蛋白质组图谱
结果2:
EOC组织和血浆样本中的恶性相关蛋白
组织样本有利于识别肿瘤特异性的生物标志物,而基于非侵入性的血液等体液样本更适合用于诊断、预后和疾病监测。因此,本研究首先在不同恶性程度的肿瘤组织中鉴定与恶性程度正相关的蛋白,随后在血液样本中验证其中的分泌性蛋白,以寻找潜在的良恶性鉴别的生物标志物。
通过比较正常、良性、交界性、早期和晚期原发癌样本的蛋白质组,研究人员鉴定了与恶性程度正相关且在原发癌中显著上调2551种蛋白质。这些蛋白质主要富集在能量代谢和肿瘤坏死因子(TNF)相关通路中。
进一步分析发现,其中43种蛋白质在人类蛋白质图谱(Human Proteome Atlas)中被注释为分泌性蛋白(secreted proteins),包括已知的EOC标志物CA125(也被称为MUC16)。
随后,在PDS-EOC队列的168份术前采集的血浆样本中,研究人员验证了其中8种蛋白质在HGSOC患者中相对非恶性肿瘤患者显著上调表达(包括MUC16、MUC1等)。值得注意的是,ASM3B的过表达在卵巢癌中首次被报道,提示其也可能作为EOC的潜在生物标志物。
基于这8个血浆蛋白质,研究人员开发了机器学习模型,用于区分卵巢癌和非癌症样本。这个分类器有望成为鉴别卵巢癌的新方法,但需要在独立的前瞻性队列中进一步验证。
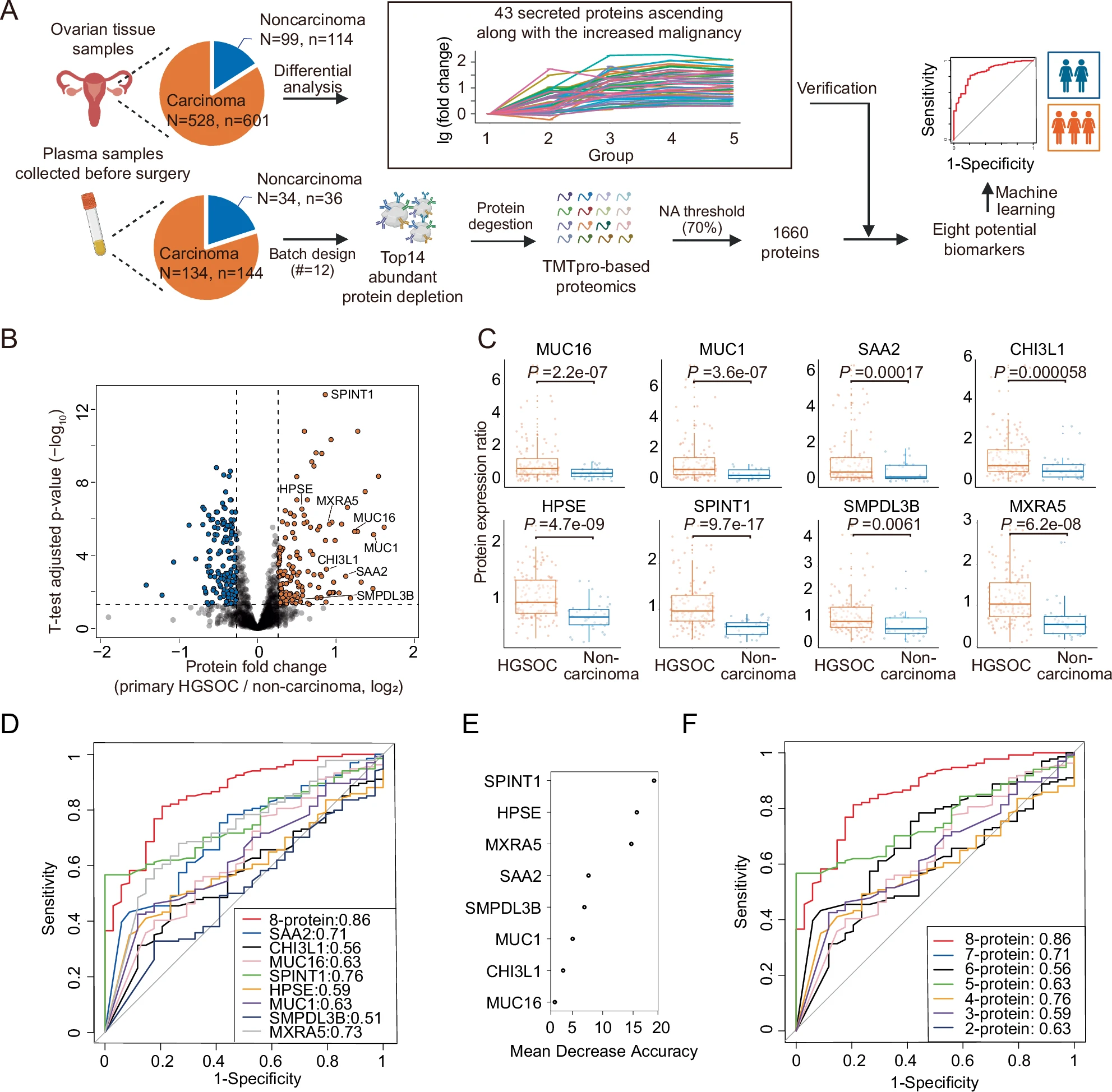
图3 血浆样本中EOC潜在生物标志物的验证
结果3:
EOC五种病理亚型的蛋白质组特征
研究人员分析了EOC五种病理亚型的蛋白质组特征,揭示了每种亚型的不同分子特征。研究系统分析了五种亚型与正常卵巢组织之间的差异表达蛋白(DEPs),共鉴定出4313种DEPs,其中2709种在五种亚型间显著失调,且其中606个表现为某一亚型特异性失调。
通过对这些亚型特异性失调蛋白的无监督聚类,发现CCOC(透明细胞卵巢癌)特异性上调的蛋白质富集在中性粒细胞脱颗粒、补体和凝血级联反应及多种代谢过程中,解释了CCOC中血栓栓塞并发症的较高发生率和糖原富集的形态。而第4簇中蛋白酶抑制剂如ITIH1、ITIH3和SERPINA1上调,且第2簇中VEGF相关的促血管生成蛋白如SMAD1和ARHGEF40下调,提示血管生成在CCOC中下调,这可能有助于解释VEGF抑制剂在临床试验中的失败。
此外,一些早期研究中提到的潜在诊断标志物在本文研究中显示出特异性不足,这些结果表明,该研究通过系统性分析五种亚型提供了比仅研究两种亚型更全面的差异生物标志物视角。
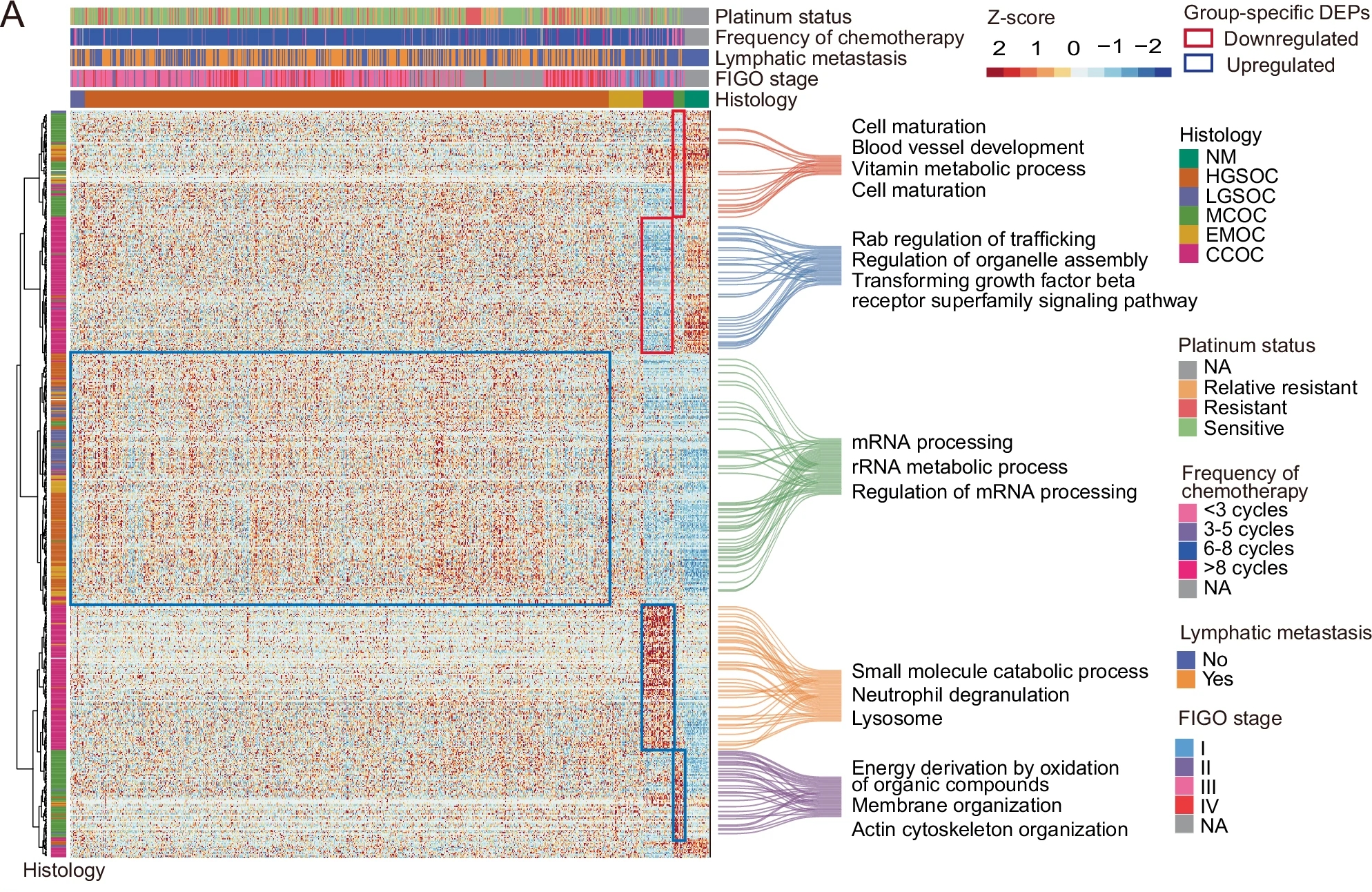
图4 相对正常卵巢组织,五种原发性EOC亚型中特异性失调的606种蛋白的表达(病理亚型特异性DEP簇以蓝色或红色框突出显示,以标记其失调)
结果4:
与晚期HGSOC预后相关的蛋白质
通过分析来自不同治疗和复发状态的三个研究队列的蛋白组数据,研究人员鉴定了多个与无复发生存期(RFS)相关的蛋白质。
这些潜在预后蛋白表现出队列特异性,如血栓反应蛋白-1 (TSP1)对血管生成的抑制在预后良好的原发手术患者中被特异性激活,PD-1/PD-L1癌症免疫治疗途径在原发手术和新辅助化疗后手术队列中均被抑制,生长激素信号通路、促红细胞生成素信号通路、ERBB4信号通路和自噬在预后不良的复发患者中被特异性抑制,以及与肌醇相关代谢在原发性和复发性HGSOC间预后作用相反。
结果5:
原发性HGSOC患者血浆中的预后蛋白
研究探索了原发性高级别浆液性卵巢癌(PDS-HGSOC)患者血浆中的预后蛋白质。通过单变量Cox回归分析,研究人员鉴定了124个不良预后相关蛋白质和73个良好预后相关蛋白质,这些蛋白质与炎症反应、细胞外基质组织修复和适应性免疫系统密切相关。
其中,α-1-抗胰蛋白酶(SERPINA1)、血小板源性生长因子A(PDGFA)和凝溶胶蛋白(GSN)的表达,被鉴定为最显著的独立于临床因素的风险因素。
此外,研究还发现了17个在PDS-HGSOC组织和血浆样本中均具有预后意义的蛋白质,其中14个被鉴定为独立预后蛋白质,主要参与免疫应答和细胞外基质组织修复。这些发现表明血浆蛋白质组学可能成为非侵入性监测卵巢癌进展的有用工具,但需要进一步在更大的队列中进行验证。
结果6:
预后预测模型
通过靶向蛋白质组学方法,研究人员验证了38个组织蛋白质和34个血浆蛋白质与预后相关。使用这些验证的蛋白特征和七个临床因素,他们开发了三个机器学习模型(模型A、B和C)。
基于五个临床因素的模型A未能区分具有显著预后差异的两组。然而,当组织或血浆蛋白特征被纳入时,组织模型B和血浆模型C都能有效地预测不同时间段内收集的外部验证队列中晚期原发性HGSOC患者的一年复发情况(Log-rank检验,p = 0.0094和 0.012)。CPTAC队列还作为一个外部验证集,验证了组织模型B在中国患者队列之外的有效性(Log-rank检验,p = 0.047)。
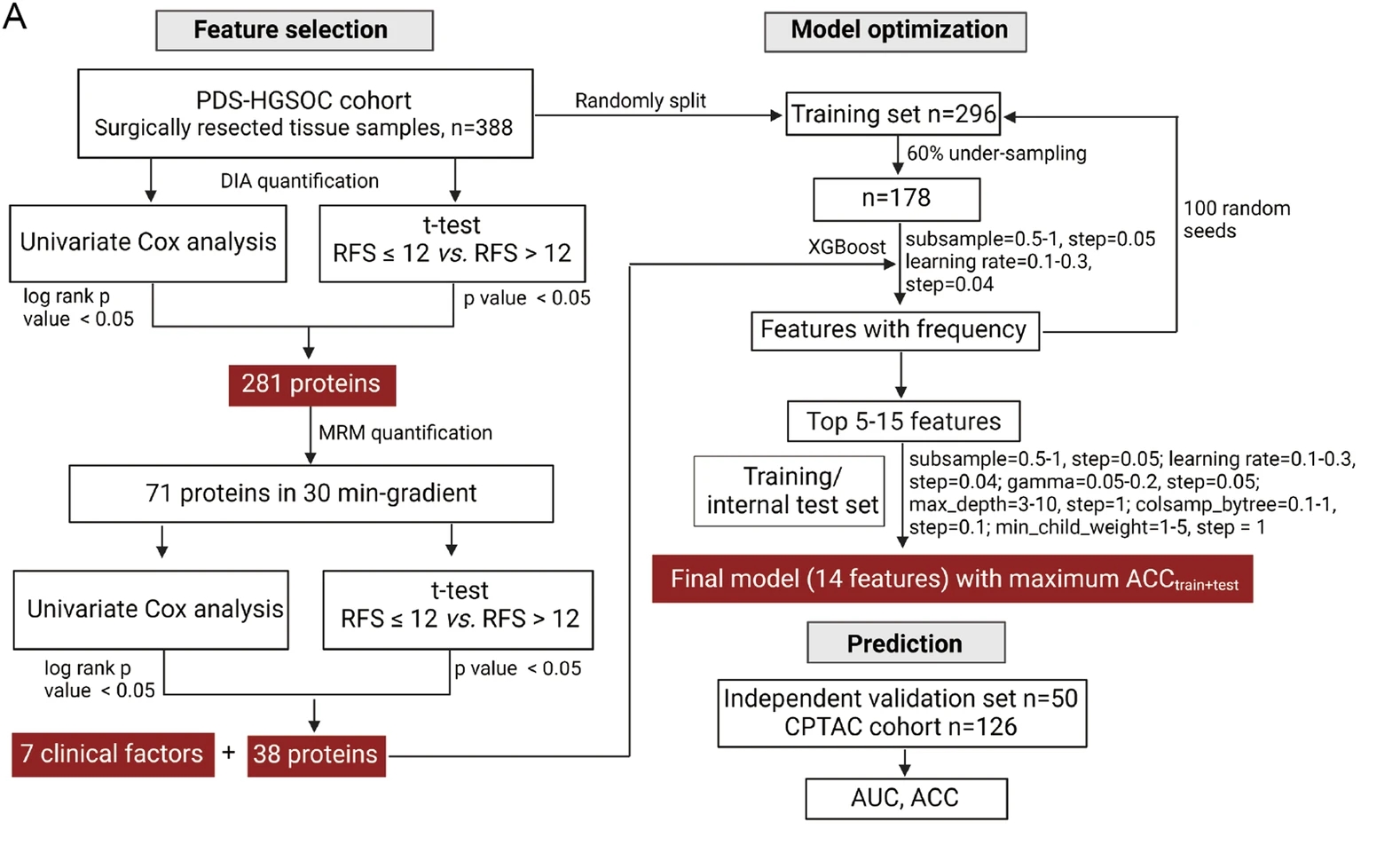
图5 基于组织蛋白质组数据的机器学习模型的工作流程
总 结
总的来说,该研究揭示了EOC不同病理类型的分子异质性,发现了潜在的诊断和复发监测标志物,并建立了复发预测的机器学习模型。研究成果为EOC的早期检测、疾病监测和个性化治疗提供了丰富的分子资源,为未来的临床应用打下了坚实的基础。






