新冠大流行期间,我们面临着不断变异的毒株和越来越普遍的突破性感染。尽管新冠疫苗的开发取得了显著成效,但随着时间的推移,个体抗体的产生和消失的异质性未知,并难以预测。
疫苗接种后引起的中和滴度抗体(NAbs)反应可以持续6-8个月,之后个体间却出现不同程度地下降。因此,明确疫苗的免疫机制对疫苗开发、免疫接种以及加强针的策略指定等非常重要。
2023年2月6日,杭州师范大学附属医院施军平教授团队、西湖大学郭天南教授团队、南京大学医学院附属鼓楼医院李婕教授团队以及西湖欧米,共同在 Protein & Cell 杂志在线发表了文章 Longitudinal proteomic investigation of COVID-19 vaccination。

通过对疫苗接种前(Day 0)、第二针疫苗接种前(Day 28)、两针疫苗接种后完全免疫(Day 57)三个时间点的血清及外周血液单个核细胞(PBMCs)进行TMT标记定量,揭示了血液学宿主反应(包括淋巴细胞迁移调控、中性粒细胞脱颗粒和体液免疫反应等),建立了基于基线蛋白标志物水平的可预测抗体生成和维持情况的机器学习模型,有望为个性化疫苗和加强针接种策略提供参考。
本研究含163名未感染新冠病毒(SARS-CoV-2)的疫苗接种者,包括一个发现队列(N = 137)和一个独立测试队列(N = 26)。所有参与者都接种了两针剂新冠灭活疫苗CoronaVac®,并进行了四次新冠病毒中和抗体的检测(疫苗接种前第0天、首剂接种后第28天、第57天和第180天)。
中和抗体检测结果显示,第28天,19.6%的参与者为抗体阳性(Group 2,早期抗体阳性组),而80.4%为抗体阴性;第57天,88.3%的参与者为抗体阳性(Group 1+2,抗体阳性组),仍然有11.7%为抗体阴性(Group 0,抗体阴性组)。在这些抗体阳性组(Group 1+2)中,180天后仅有33.1%的抗体阳性受试者仍保持阳性(Group 4,持续抗体阳性组)(图1)。
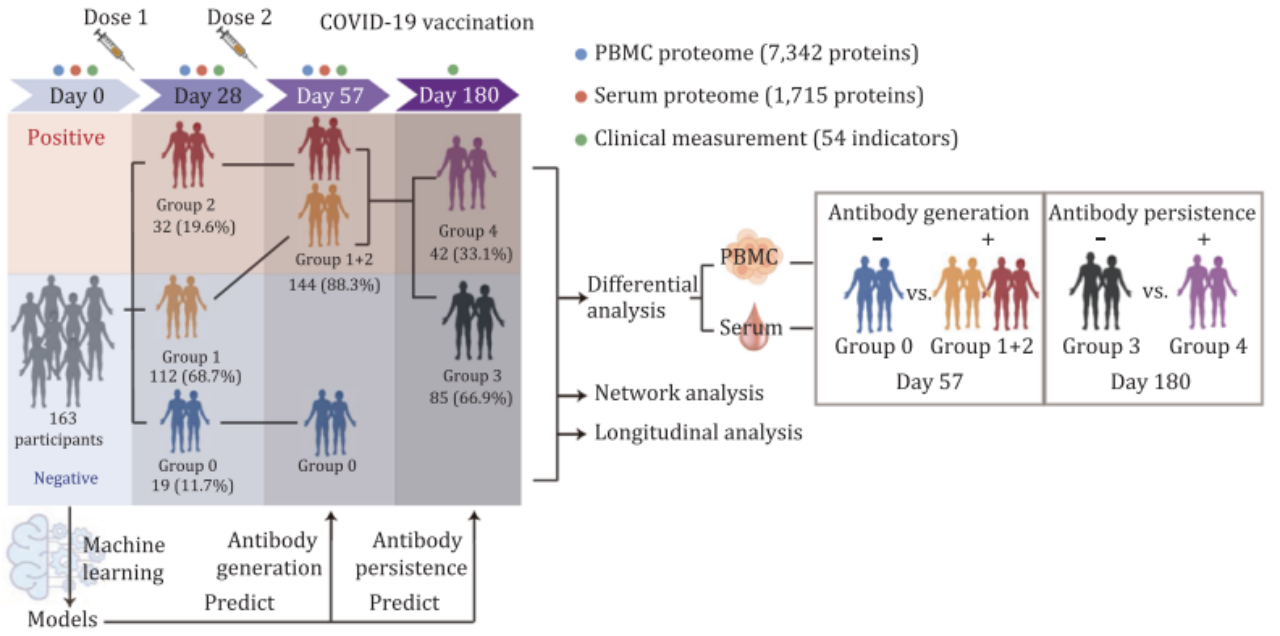
图1. 实验设计,依据抗体产生和维持情况对参与者进行了分组
该研究开发了基于疫苗接种前PBMC和血清蛋白质表达水平的机器学习模型,以预测疫苗接种后第57天的抗体产生情况,可以实现AUC 0.84(PBMC模型)、0.82(血清模型)、0.87(联合模型)。表明这些基于基线蛋白标志物水平可以较为精准地预测抗体生成情况。
那么,产生抗体人群在疫苗接种后三个月(Day 180)是否还能维持抗体阳性?基于此,我们也进行了机器学习建模,最后PBMC模型表现最好(AUC为0.79)。以上模型可用于预测疫苗接种后没有产生有效抗体,以及产生抗体后续降低的个体,为疫苗接种策略提供参考。
为了研究抗体阳性和阴性者的生物学变化,我们使用PBMC数据分析了血清抗体阳性组和阴性组之间的差异。发现接种疫苗之后,抗体阳性组的先天免疫和适应性免疫增强,相关的信号通路上调,涉及IFNg,IFNa和IFNb信号传导,RNA和DNA调控以及代谢相关通路。
血清数据显示,不同免疫应答组间差异集中在中性粒细胞脱颗粒、急性期反应和凝血相关通路,并且大部分蛋白在抗体阳性组中上调。已有研究表明,载脂蛋白家族可以诱导白细胞的活化,特别是中性粒细胞的脱颗粒。这一发现表明,代谢和免疫的相互作用与血清转换密切相关。

图2. 抗体阳性和阴性组间免疫反应的功能和网络分析
总的来说,这项工作针对宿主对疫苗接种后的不同反应,进行了系统的PBMC和血清蛋白质组学研究,揭示了疫苗接种后免疫应答不同人群的潜在分子调控机制,开发了基于基线(疫苗接种前)的PBMC和血清蛋白质的机器学习模型,以预测疫苗接种后57天的抗体产生,以及180天的抗体维持情况,有望为疫苗接种策略提供参考。

新冠大流行期间,我们面临着不断变异的毒株和越来越普遍的突破性感染。尽管新冠疫苗的开发取得了显著成效,但随着时间的推移,个体抗体的产生和消失的异质性未知,并难以预测。
疫苗接种后引起的中和滴度抗体(NAbs)反应可以持续6-8个月,之后个体间却出现不同程度地下降。因此,明确疫苗的免疫机制对疫苗开发、免疫接种以及加强针的策略指定等非常重要。
2023年2月6日,杭州师范大学附属医院施军平教授团队、西湖大学郭天南教授团队、南京大学医学院附属鼓楼医院李婕教授团队以及西湖欧米,共同在 Protein & Cell 杂志在线发表了文章 Longitudinal proteomic investigation of COVID-19 vaccination。

通过对疫苗接种前(Day 0)、第二针疫苗接种前(Day 28)、两针疫苗接种后完全免疫(Day 57)三个时间点的血清及外周血液单个核细胞(PBMCs)进行TMT标记定量,揭示了血液学宿主反应(包括淋巴细胞迁移调控、中性粒细胞脱颗粒和体液免疫反应等),建立了基于基线蛋白标志物水平的可预测抗体生成和维持情况的机器学习模型,有望为个性化疫苗和加强针接种策略提供参考。
本研究含163名未感染新冠病毒(SARS-CoV-2)的疫苗接种者,包括一个发现队列(N = 137)和一个独立测试队列(N = 26)。所有参与者都接种了两针剂新冠灭活疫苗CoronaVac®,并进行了四次新冠病毒中和抗体的检测(疫苗接种前第0天、首剂接种后第28天、第57天和第180天)。
中和抗体检测结果显示,第28天,19.6%的参与者为抗体阳性(Group 2,早期抗体阳性组),而80.4%为抗体阴性;第57天,88.3%的参与者为抗体阳性(Group 1+2,抗体阳性组),仍然有11.7%为抗体阴性(Group 0,抗体阴性组)。在这些抗体阳性组(Group 1+2)中,180天后仅有33.1%的抗体阳性受试者仍保持阳性(Group 4,持续抗体阳性组)(图1)。

图1. 实验设计,依据抗体产生和维持情况对参与者进行了分组
该研究开发了基于疫苗接种前PBMC和血清蛋白质表达水平的机器学习模型,以预测疫苗接种后第57天的抗体产生情况,可以实现AUC 0.84(PBMC模型)、0.82(血清模型)、0.87(联合模型)。表明这些基于基线蛋白标志物水平可以较为精准地预测抗体生成情况。
那么,产生抗体人群在疫苗接种后三个月(Day 180)是否还能维持抗体阳性?基于此,我们也进行了机器学习建模,最后PBMC模型表现最好(AUC为0.79)。以上模型可用于预测疫苗接种后没有产生有效抗体,以及产生抗体后续降低的个体,为疫苗接种策略提供参考。
为了研究抗体阳性和阴性者的生物学变化,我们使用PBMC数据分析了血清抗体阳性组和阴性组之间的差异。发现接种疫苗之后,抗体阳性组的先天免疫和适应性免疫增强,相关的信号通路上调,涉及IFNg,IFNa和IFNb信号传导,RNA和DNA调控以及代谢相关通路。
血清数据显示,不同免疫应答组间差异集中在中性粒细胞脱颗粒、急性期反应和凝血相关通路,并且大部分蛋白在抗体阳性组中上调。已有研究表明,载脂蛋白家族可以诱导白细胞的活化,特别是中性粒细胞的脱颗粒。这一发现表明,代谢和免疫的相互作用与血清转换密切相关。

图2. 抗体阳性和阴性组间免疫反应的功能和网络分析
总的来说,这项工作针对宿主对疫苗接种后的不同反应,进行了系统的PBMC和血清蛋白质组学研究,揭示了疫苗接种后免疫应答不同人群的潜在分子调控机制,开发了基于基线(疫苗接种前)的PBMC和血清蛋白质的机器学习模型,以预测疫苗接种后57天的抗体产生,以及180天的抗体维持情况,有望为疫苗接种策略提供参考。