♦ 研究背景及简介
胃肠道生态系统是一个高度复杂的环境,对人类健康有着深远的影响。与肠道微生物相关的肠道炎症与包括1型糖尿病(T1D)在内的多种人类疾病的发生发展相关。T1D是一种自身免疫性疾病,由免疫细胞破坏胰岛中产生胰岛素的β细胞引起。T1D的发病率在过去50年中一直在稳步上升,尤其是较小的儿童和携带低风险HLA单倍型的人群,这表明早期生活中基因-环境相互作用发生了改变。
T1D有多种环境危险因素,如生命早期饮食(包括母乳喂养以及添加固体食物的时间和类型)、儿童肥胖和感染(尤其是肠道病毒感染)相关。这些危险因素强烈提示肠道微生物的参与,肠道菌群落改变(生态失调)、肠道通透性增加和肠道免疫激活均在T1D诊断之前被报道。
感染胃肠道的病毒,尤其是肠道病毒,也被认为可能通过重叠机制在T1D发病机制中起重要作用。然而,尚不清楚微生物群和病毒群是否共同作用,或者在胰岛自身免疫开始时哪个风险因素可能更重要。
2022年12月,来自澳大利亚昆士兰大学的Patrick G. Gavin及其团队在Microbiome(IF: 16.837)发表了名为 Multi-omic interactions in the gut of children at the onset of islet autoimmunity 的研究。
该研究收集了40名T1D风险增加的儿童在胰岛自身免疫发病前后的粪便样本,结合病毒组、微生物组和宏蛋白质组技术。
研究表明幼儿肠道微生物群、宏蛋白质组和病毒组之间的相互关系,肠道微生物群的功能重塑伴随着胰岛自身免疫和病毒感染,并在胰岛自身免疫开始时发生了功能转换。

♦ 研究样本
(1)研究队列和样本:40名儿童(包含20名持续性IAb患者与20名对照),采集血清转化前后的64份粪便样本。
(2)组学方法:16S、宏蛋白组。
♦ 研究结果
◊微生物多样性和丰度与年龄相关
粪便微生物群的丰富度和均匀度在幼儿期稳步增加(图1A),病例组和对照组的α多样性没有显著差异(图1B),PCoA显示年龄以及拟杆菌门和厚壁菌门的比例对第一个主成分的强烈影响(图1C-E)。
18个OTUs与样本年龄显著相关,其中包括3个拟杆菌科、8个梭菌目(其中4个瘤胃球菌科和5个毛螺菌科),它们随着年龄的增长而增加(q < 0.1)。一个丹毒丝菌科的OTU随着年龄的增长而减少。
这些结果与之前的报告一致,即在儿童早期采用固体食物后厚壁菌门的比例增加,而在停止母乳喂养后丹毒丝菌科的比例下降。

图1. 微生物多样性和丰度与年龄相关
◊ 儿童早期宏蛋白质组的动力学
微生物的蛋白质数目在三岁前迅速增加,之后趋于稳定,这与扩增子测序中观察到变化相似(图2A)。宏蛋白组鉴定到的微生物数目与16S检测到的OTUs高度相关(R = 0.83,p < 0.001)。人类蛋白质数目在各个年龄阶段都是稳定的,尽管免疫球蛋白可变区的丰富度和强度随着年龄的增长而下降(图2A)。
有趣的是,没有任何一类特异性免疫球蛋白与年龄显著相关,表明单个可变区可能来自多个抗体。人类和微生物蛋白的总体数量和强度均与病例-对照状态无关。粪便蛋白质组的主成分分析显示,年龄与第一主成分有很强的相关性(图2C)。
单因素分析发现28个人类蛋白质和45个微生物蛋白质与儿童的年龄相关。宿主蛋白主要包含19种免疫球蛋白,它们随着年龄的增长而减少,然而大部分微生物蛋白在增加。宿主蛋白还包括MUC1、CLCA1、DMBT1(也称为SALSA)和乳转铁蛋白(TRFL),它们参与肠道屏障维护和抗微生物防御。
与年龄相关的微生物蛋白包括谷氨酸脱氢酶,主要来源于厚壁菌门。大多数与年龄相关的其他微生物蛋白属于普遍存在的途径,包括糖酵解,主要来自厚壁菌门。
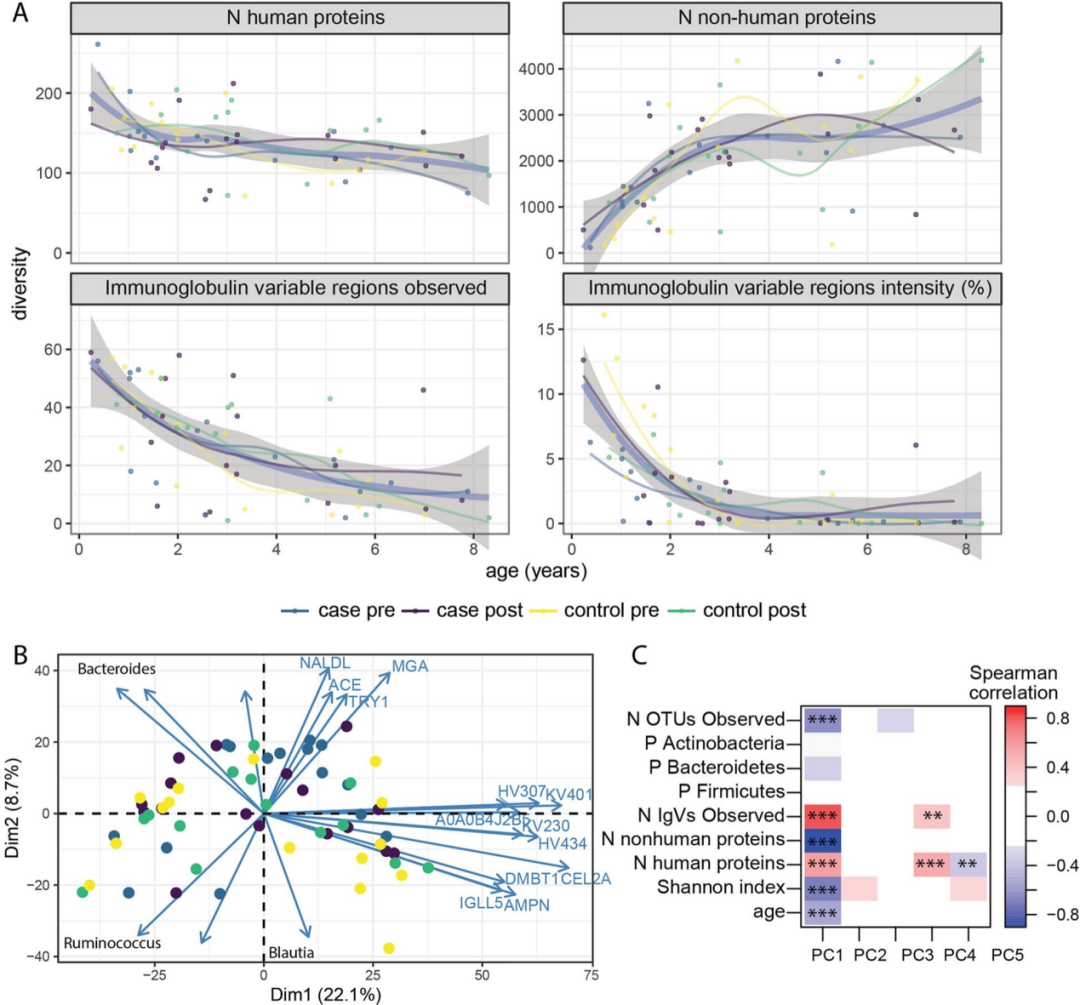
图2. 儿童早期宏蛋白质组的动力学
◊ 肠道微生物组和宏蛋白质组与儿童早期病毒感染的关联
作者使用混合效应模型研究了肠道病毒组、微生物组和宏蛋白质组之间的关系。病毒阳性患者通常拥有更低的微生物多样性。病毒阳性与Dorea属的相对丰度呈负相关(q = 0.058,图3A),与Blautia 和 Sharpea呈正相关(图3B)。
一种来自拟杆菌的热休克蛋白GroES与肠道病毒感染相关(图3C)。相比之下,28种微生物蛋白与腺病毒的存在相关(图3D)。
这些数据表明肠道微生物群的功能重塑伴随着腺病毒的感染。其中5种谷氨酸脱氢酶(GLUD1s)和4种红霉素类蛋白表达下降,3种ABC类转运蛋白表达上调。GLUD1蛋白与年龄相关的蛋白不同,其变化方向一致,起源于多个不同的厚壁菌门和变形菌门。
这表明微生物群功能改变,而不是特异性细菌丰度发生了变化。
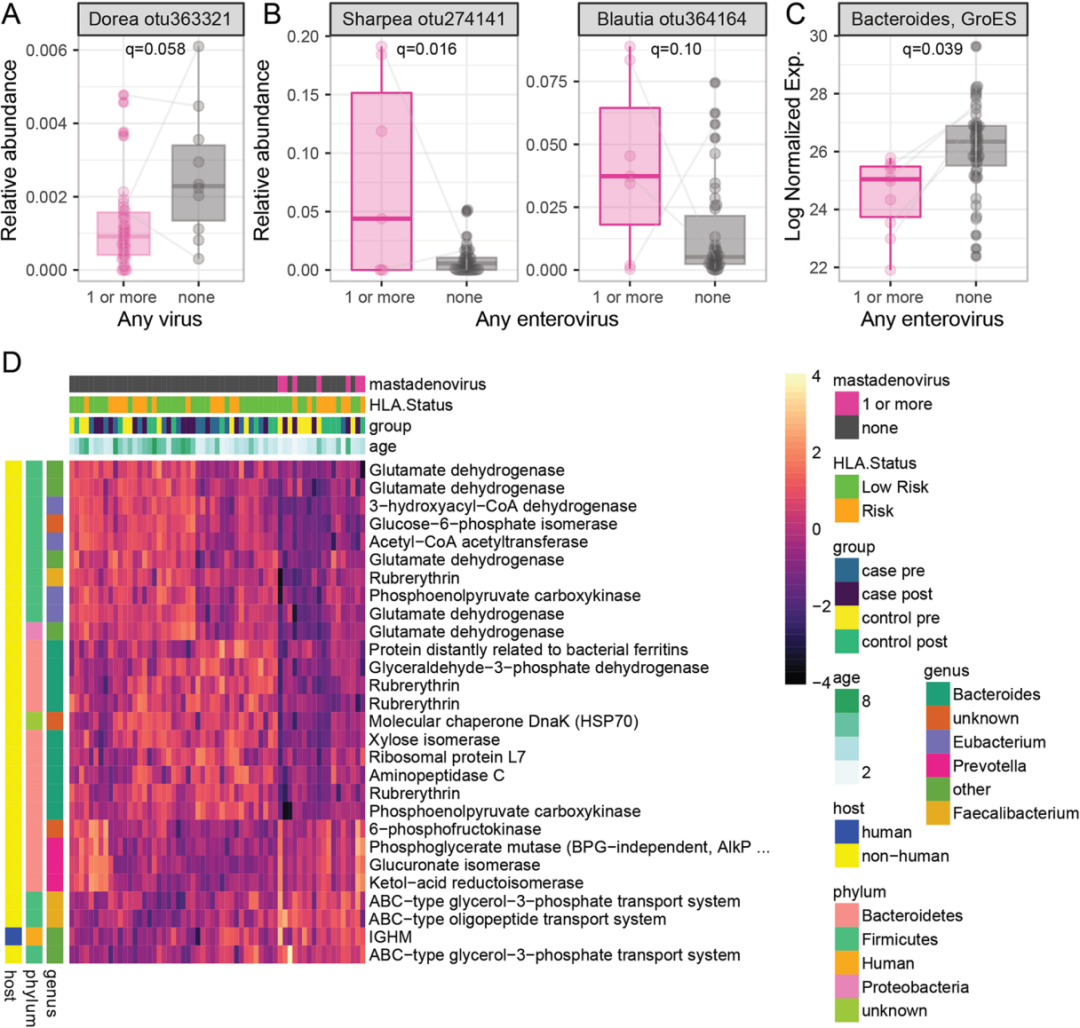
图3. 与病毒感染相关的微生物特征
◊微生物丰度和宏蛋白质组与胰岛自身免疫的关系
作者进一步研究胰岛自身免疫与微生物或蛋白质丰度之间的关系。单因素分析发现,只有一个瘤胃球菌科的未分类OTU在对照组中丰度更高(图4A)。在交互试验中发现了另一种瘤胃球菌科未分类的OTU,在对照组中随着时间增加,但在血清转化后减少(图4B)。
与对照组相比,患病组来自F. prausnitzii的ABC转运蛋白和CEAM7的检测水平有所增加(图4C)。CEAM7是一种在结肠、直肠和胰管上皮细胞上表达的细胞粘附分子。
三种蛋白在病例样本血清转化前更丰富,在血清转化后减少,而在对照组中,它们随着时间的推移而增加(图4D),前两种分别是来自粪杆菌属的糖醛酸异构酶和SAICAR酶,前者参与葡萄糖和次生代谢物的降解,SAICAR参与嘌呤核苷酸生物合成。第三种是一种ABC类转运蛋白lipoprotein Med,起源于瘤胃球菌科的亚球菌属。
总之,这些变化表明瘤胃球菌科几个成员的功能改变与胰岛自身免疫的发生有关。
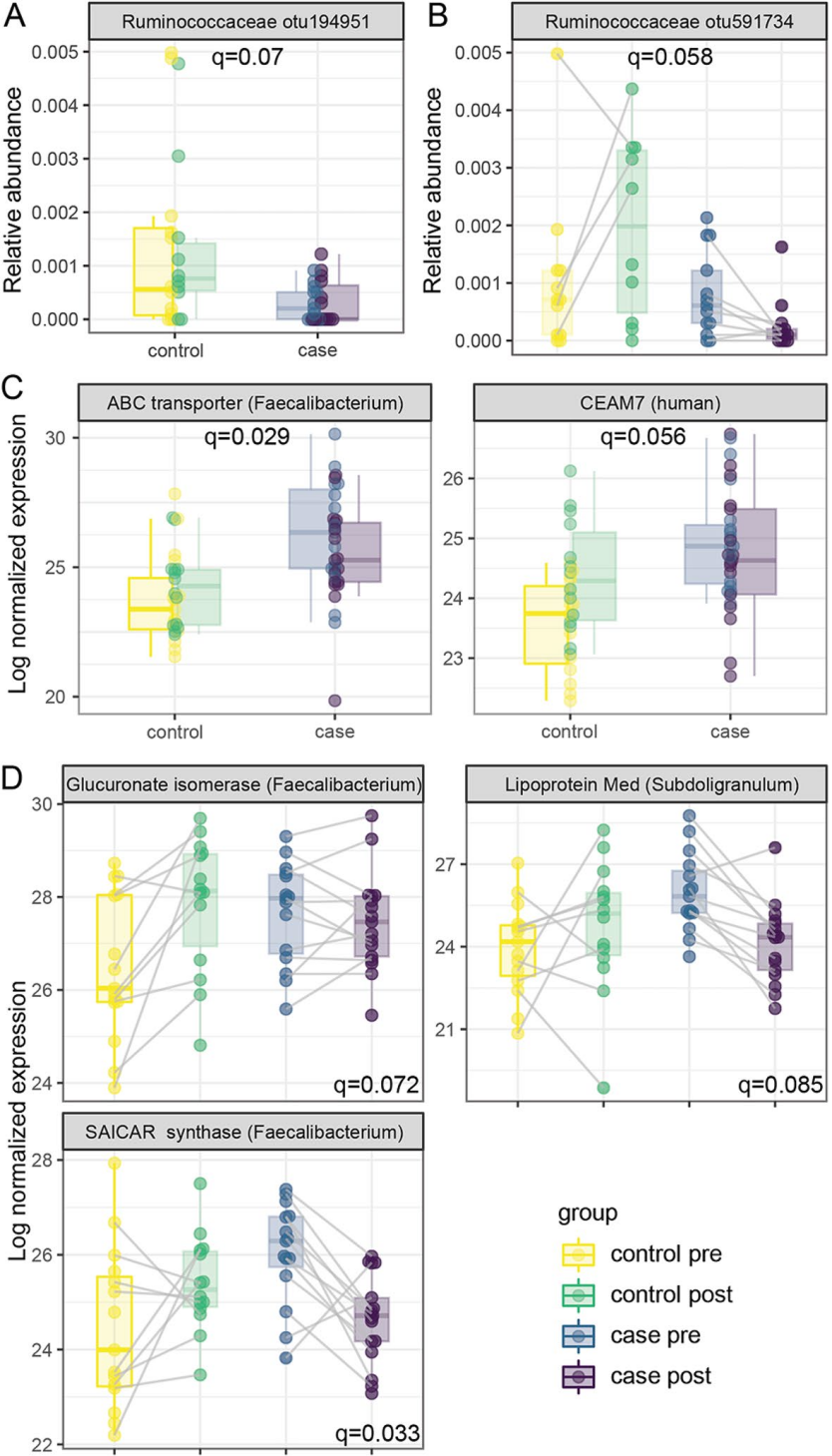
图4. 微生物组和宏蛋白质组与胰岛自身免疫有关
◊ 多组学分析确定了与年龄、免疫球蛋白、腺病毒和胰岛自身免疫相关的潜在因素
使用多组学分析(MOFA)对数据集进行了整合,为了评估年龄在微生物组、人类蛋白质组和微生物蛋白质组上的非线性影响。该模型识别了8个潜在因素(图5A,B)。
LF1与年龄不相关,但与OTUs数量、检测到的非人类蛋白数量和检测到的IGV数量相关(图5B)。LF1和LF2上的IGV片段有明显的差异(图5B,C),表明抗体在塑造微生物组和蛋白质组中发挥着重要作用。LF6在病例和对照组之间存在差异(q = 0.09),并表现出显著的病例-时间交互作用(q = 0.06,图5F)。
对LF6中的前20个蛋白进一步分析,发现来自粪杆菌属(11个蛋白)和拟杆菌属(3个蛋白)的蛋白有很强的代表性(图6)。有趣的是,随着时间的推移,粪杆菌蛋白在血清转化后减少,在对照组中增加,而拟杆菌则表现出相反的趋势。
引人注目的是,在前20个蛋白中有9个ABCtype转运蛋白(图6),说明在发生胰岛自身免疫的儿童中,甘油-3-磷酸或糖的转运发生了改变,可能是细菌对底物的利用发生了改变。总之,微生物和人类蛋白质的全表达谱确定了发生胰岛自身免疫的儿童与未发生胰岛自身免疫的儿童之间不同的潜在因素。
结果表明微生物蛋白与胰岛自身免疫发作相关,而非微生物分类群、人类蛋白质或病毒,微生物群的功能活性可能是与血清转化相关的关键因素。
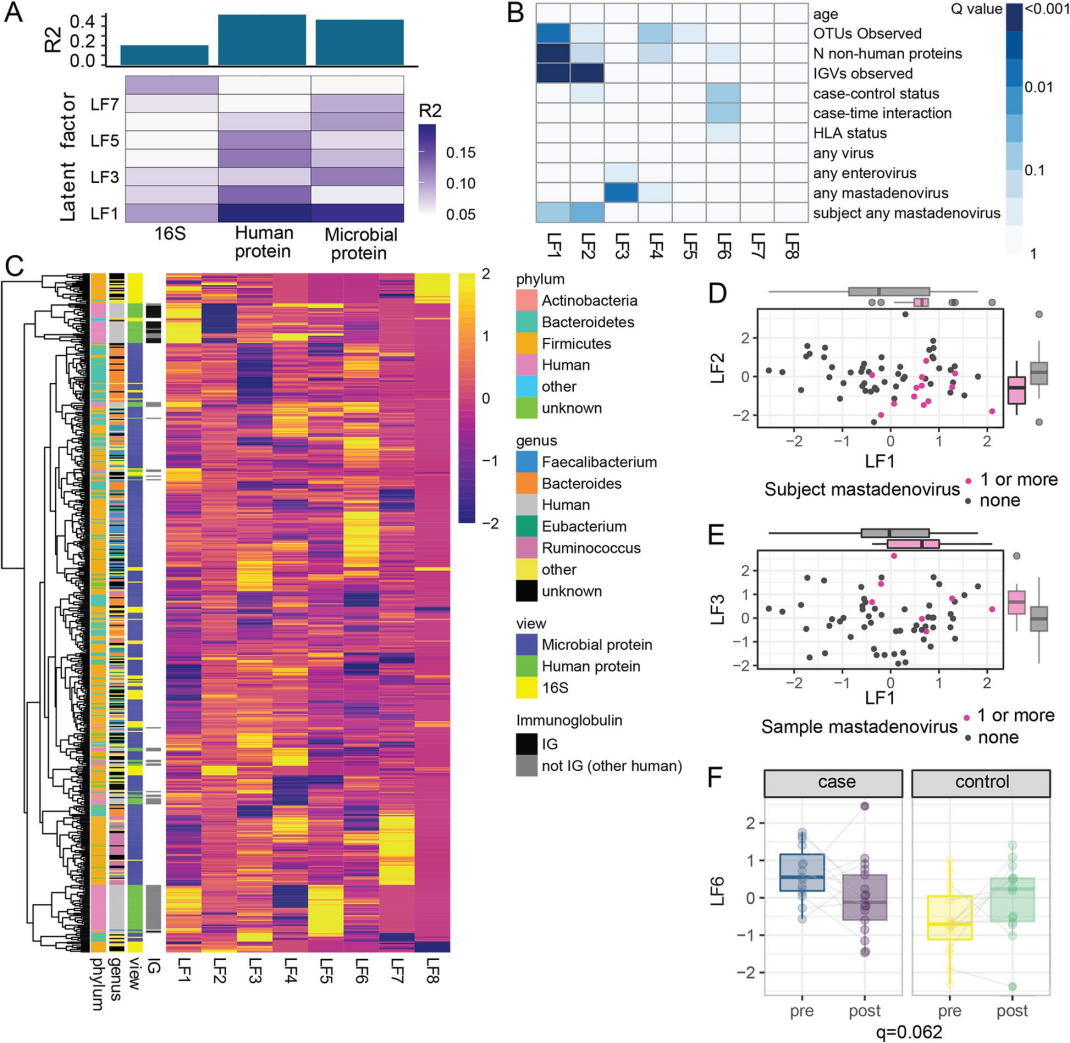
图5. 多组学模型可识别与免疫球蛋白、腺病毒和胰岛自身免疫相关的潜在因子

图6. 与模型LF6相关的前20个变量
♦ 文章小结
本研究证实了幼儿肠道微生物、宏蛋白质组和病毒组之间的相互关系。研究发现了一种以前未被认识到的腺病毒感染与肠道微生物功能之间的关联,这可能在疾病风险中发挥作用。
引人注目的是,我们发现粪杆菌功能转换可能与胰岛自身免疫的发病有关。
这表明肠道微生物群的改变参与了T1D的发病机制,而旨在重新训练肠道微生物的治疗策略可能是预防T1D的一种有前途的方法。
♦ 研究背景及简介
胃肠道生态系统是一个高度复杂的环境,对人类健康有着深远的影响。与肠道微生物相关的肠道炎症与包括1型糖尿病(T1D)在内的多种人类疾病的发生发展相关。T1D是一种自身免疫性疾病,由免疫细胞破坏胰岛中产生胰岛素的β细胞引起。T1D的发病率在过去50年中一直在稳步上升,尤其是较小的儿童和携带低风险HLA单倍型的人群,这表明早期生活中基因-环境相互作用发生了改变。
T1D有多种环境危险因素,如生命早期饮食(包括母乳喂养以及添加固体食物的时间和类型)、儿童肥胖和感染(尤其是肠道病毒感染)相关。这些危险因素强烈提示肠道微生物的参与,肠道菌群落改变(生态失调)、肠道通透性增加和肠道免疫激活均在T1D诊断之前被报道。
感染胃肠道的病毒,尤其是肠道病毒,也被认为可能通过重叠机制在T1D发病机制中起重要作用。然而,尚不清楚微生物群和病毒群是否共同作用,或者在胰岛自身免疫开始时哪个风险因素可能更重要。
2022年12月,来自澳大利亚昆士兰大学的Patrick G. Gavin及其团队在Microbiome(IF: 16.837)发表了名为 Multi-omic interactions in the gut of children at the onset of islet autoimmunity 的研究。
该研究收集了40名T1D风险增加的儿童在胰岛自身免疫发病前后的粪便样本,结合病毒组、微生物组和宏蛋白质组技术。
研究表明幼儿肠道微生物群、宏蛋白质组和病毒组之间的相互关系,肠道微生物群的功能重塑伴随着胰岛自身免疫和病毒感染,并在胰岛自身免疫开始时发生了功能转换。

♦ 研究样本
(1)研究队列和样本:40名儿童(包含20名持续性IAb患者与20名对照),采集血清转化前后的64份粪便样本。
(2)组学方法:16S、宏蛋白组。
♦ 研究结果
◊微生物多样性和丰度与年龄相关
粪便微生物群的丰富度和均匀度在幼儿期稳步增加(图1A),病例组和对照组的α多样性没有显著差异(图1B),PCoA显示年龄以及拟杆菌门和厚壁菌门的比例对第一个主成分的强烈影响(图1C-E)。
18个OTUs与样本年龄显著相关,其中包括3个拟杆菌科、8个梭菌目(其中4个瘤胃球菌科和5个毛螺菌科),它们随着年龄的增长而增加(q < 0.1)。一个丹毒丝菌科的OTU随着年龄的增长而减少。
这些结果与之前的报告一致,即在儿童早期采用固体食物后厚壁菌门的比例增加,而在停止母乳喂养后丹毒丝菌科的比例下降。

图1. 微生物多样性和丰度与年龄相关
◊ 儿童早期宏蛋白质组的动力学
微生物的蛋白质数目在三岁前迅速增加,之后趋于稳定,这与扩增子测序中观察到变化相似(图2A)。宏蛋白组鉴定到的微生物数目与16S检测到的OTUs高度相关(R = 0.83,p < 0.001)。人类蛋白质数目在各个年龄阶段都是稳定的,尽管免疫球蛋白可变区的丰富度和强度随着年龄的增长而下降(图2A)。
有趣的是,没有任何一类特异性免疫球蛋白与年龄显著相关,表明单个可变区可能来自多个抗体。人类和微生物蛋白的总体数量和强度均与病例-对照状态无关。粪便蛋白质组的主成分分析显示,年龄与第一主成分有很强的相关性(图2C)。
单因素分析发现28个人类蛋白质和45个微生物蛋白质与儿童的年龄相关。宿主蛋白主要包含19种免疫球蛋白,它们随着年龄的增长而减少,然而大部分微生物蛋白在增加。宿主蛋白还包括MUC1、CLCA1、DMBT1(也称为SALSA)和乳转铁蛋白(TRFL),它们参与肠道屏障维护和抗微生物防御。
与年龄相关的微生物蛋白包括谷氨酸脱氢酶,主要来源于厚壁菌门。大多数与年龄相关的其他微生物蛋白属于普遍存在的途径,包括糖酵解,主要来自厚壁菌门。

图2. 儿童早期宏蛋白质组的动力学
◊ 肠道微生物组和宏蛋白质组与儿童早期病毒感染的关联
作者使用混合效应模型研究了肠道病毒组、微生物组和宏蛋白质组之间的关系。病毒阳性患者通常拥有更低的微生物多样性。病毒阳性与Dorea属的相对丰度呈负相关(q = 0.058,图3A),与Blautia 和 Sharpea呈正相关(图3B)。
一种来自拟杆菌的热休克蛋白GroES与肠道病毒感染相关(图3C)。相比之下,28种微生物蛋白与腺病毒的存在相关(图3D)。
这些数据表明肠道微生物群的功能重塑伴随着腺病毒的感染。其中5种谷氨酸脱氢酶(GLUD1s)和4种红霉素类蛋白表达下降,3种ABC类转运蛋白表达上调。GLUD1蛋白与年龄相关的蛋白不同,其变化方向一致,起源于多个不同的厚壁菌门和变形菌门。
这表明微生物群功能改变,而不是特异性细菌丰度发生了变化。

图3. 与病毒感染相关的微生物特征
◊微生物丰度和宏蛋白质组与胰岛自身免疫的关系
作者进一步研究胰岛自身免疫与微生物或蛋白质丰度之间的关系。单因素分析发现,只有一个瘤胃球菌科的未分类OTU在对照组中丰度更高(图4A)。在交互试验中发现了另一种瘤胃球菌科未分类的OTU,在对照组中随着时间增加,但在血清转化后减少(图4B)。
与对照组相比,患病组来自F. prausnitzii的ABC转运蛋白和CEAM7的检测水平有所增加(图4C)。CEAM7是一种在结肠、直肠和胰管上皮细胞上表达的细胞粘附分子。
三种蛋白在病例样本血清转化前更丰富,在血清转化后减少,而在对照组中,它们随着时间的推移而增加(图4D),前两种分别是来自粪杆菌属的糖醛酸异构酶和SAICAR酶,前者参与葡萄糖和次生代谢物的降解,SAICAR参与嘌呤核苷酸生物合成。第三种是一种ABC类转运蛋白lipoprotein Med,起源于瘤胃球菌科的亚球菌属。
总之,这些变化表明瘤胃球菌科几个成员的功能改变与胰岛自身免疫的发生有关。

图4. 微生物组和宏蛋白质组与胰岛自身免疫有关
◊ 多组学分析确定了与年龄、免疫球蛋白、腺病毒和胰岛自身免疫相关的潜在因素
使用多组学分析(MOFA)对数据集进行了整合,为了评估年龄在微生物组、人类蛋白质组和微生物蛋白质组上的非线性影响。该模型识别了8个潜在因素(图5A,B)。
LF1与年龄不相关,但与OTUs数量、检测到的非人类蛋白数量和检测到的IGV数量相关(图5B)。LF1和LF2上的IGV片段有明显的差异(图5B,C),表明抗体在塑造微生物组和蛋白质组中发挥着重要作用。LF6在病例和对照组之间存在差异(q = 0.09),并表现出显著的病例-时间交互作用(q = 0.06,图5F)。
对LF6中的前20个蛋白进一步分析,发现来自粪杆菌属(11个蛋白)和拟杆菌属(3个蛋白)的蛋白有很强的代表性(图6)。有趣的是,随着时间的推移,粪杆菌蛋白在血清转化后减少,在对照组中增加,而拟杆菌则表现出相反的趋势。
引人注目的是,在前20个蛋白中有9个ABCtype转运蛋白(图6),说明在发生胰岛自身免疫的儿童中,甘油-3-磷酸或糖的转运发生了改变,可能是细菌对底物的利用发生了改变。总之,微生物和人类蛋白质的全表达谱确定了发生胰岛自身免疫的儿童与未发生胰岛自身免疫的儿童之间不同的潜在因素。
结果表明微生物蛋白与胰岛自身免疫发作相关,而非微生物分类群、人类蛋白质或病毒,微生物群的功能活性可能是与血清转化相关的关键因素。

图5. 多组学模型可识别与免疫球蛋白、腺病毒和胰岛自身免疫相关的潜在因子

图6. 与模型LF6相关的前20个变量
♦ 文章小结
本研究证实了幼儿肠道微生物、宏蛋白质组和病毒组之间的相互关系。研究发现了一种以前未被认识到的腺病毒感染与肠道微生物功能之间的关联,这可能在疾病风险中发挥作用。
引人注目的是,我们发现粪杆菌功能转换可能与胰岛自身免疫的发病有关。
这表明肠道微生物群的改变参与了T1D的发病机制,而旨在重新训练肠道微生物的治疗策略可能是预防T1D的一种有前途的方法。