1月14日,丹麦哥本哈根大学蛋白质研究中心、德国 Max Plank 生物化学研究所 Matthias Mann 团队在 Molecular cell 发表了空间蛋白质组学研究的 resource 文章。通过高度多路复用成像(highly multiplexed imaging)和深度视觉蛋白质组学(DVP) 方法揭示了肿瘤免疫微环境中的功能性肿瘤-免疫相互作用。

图1 文章截图
「提纲挈领」
文章通过mipDVP方法,结合高度多路复用成像、单细胞激光显微切割和灵敏的质谱分析,深入探讨了肿瘤免疫微环境中的细胞间相互作用。研究重点分析了两种不同类型的肿瘤:结直肠癌(冷肿瘤)和扁桃体癌(热肿瘤)。
在结直肠癌中,发现了免疫抑制性巨噬细胞屏障的空间隔离,这可能阻碍了T细胞的浸润,且T细胞在不同肿瘤区室中的功能状态各异。与此不同,在扁桃体癌中,研究揭示了T细胞的异质性,特别是细胞毒性T淋巴细胞(CTLs)与肿瘤细胞之间的空间关系,且T细胞在肿瘤实质区呈现代谢适应现象,特别是应对低氧环境。
通过这一空间解析的高通量技术,研究提供了对肿瘤免疫微环境中复杂细胞相互作用的深刻理解,为肿瘤免疫治疗的靶点识别和预后标志物的筛选提供了重要见解。

图2 图文摘要
结果1:
单细胞肿瘤空间蛋白质组学
为了描绘肿瘤免疫微环境(TME)的空间分子图谱,研究人员使用MACSima成像平台进行14- to 22-plex的免疫荧光染色,结合LC-MS分析,成功获得结直肠癌(CRC)和扁桃体癌样本中不同细胞类型的空间信息。染色和成像过程的效率非常高,能够在不到50小时内完成30mm²组织区域的标记,并确保对稀有细胞类型的有效分析。
该技术能够高效地描绘肿瘤、免疫细胞与基质细胞的空间分布,特别是在解析肿瘤微环境中的免疫反应区域(如三级淋巴结构TLS)时具有重要价值。
此外,MACSima染色对蛋白质组分析的影响极小,证明了该技术在肿瘤样本的空间蛋白质组学分析中的可靠性和高效性。
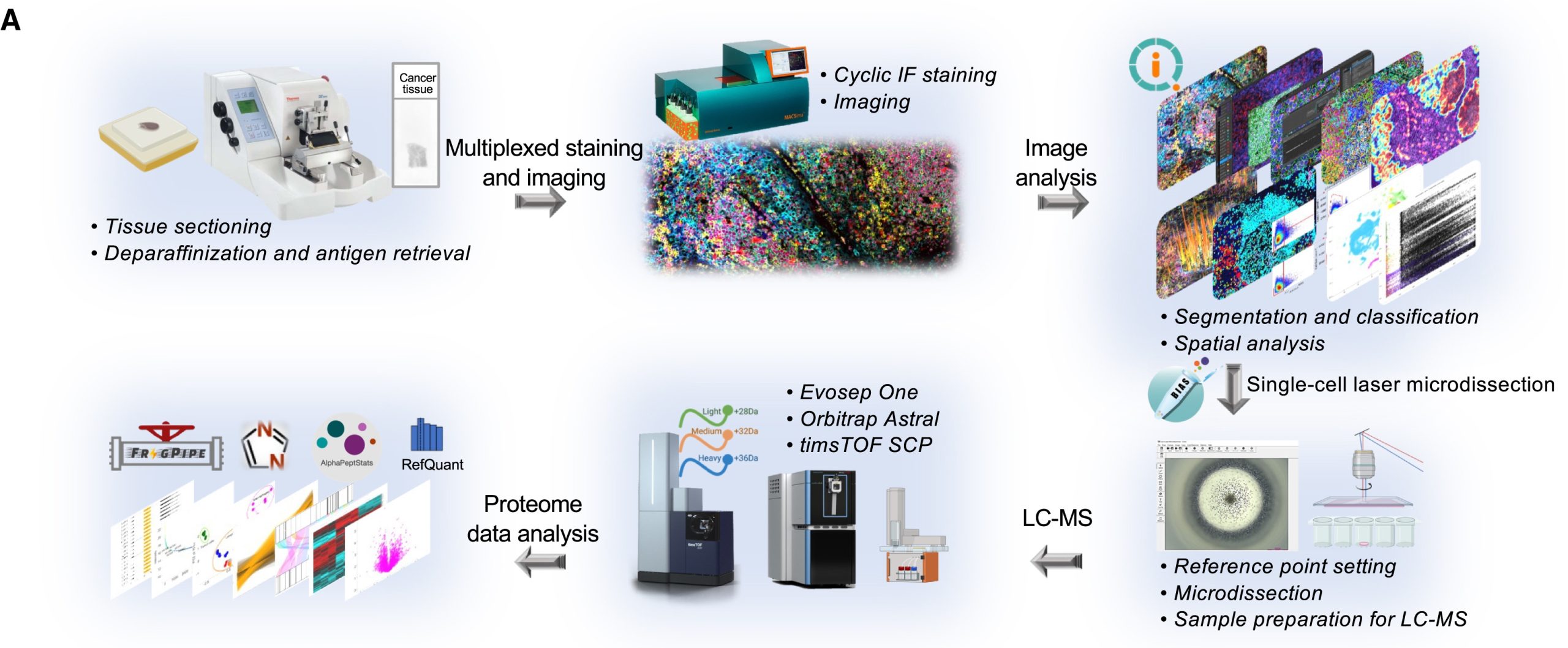
图3 mipDVP工作流程示意图。mipDVP整合了多重染色和基于质谱的蛋白质组学,可在保留组织微环境空间背景的同时进行深度蛋白质组学分析。
结果2:
巨噬细胞在结直肠癌中形成免疫抑制屏障,可能阻碍T细胞的浸润
在结直肠癌(CRC)样本中,巨噬细胞在肿瘤上皮与基质层之间形成屏障,且表达较低的HLA-DR,表明其抗原呈递能力下降,具有免疫抑制作用。
免疫细胞(如CTLs和TH)主要集中在肿瘤固有层(lamina propria),而巨噬细胞则更多集中于肿瘤上皮区,靠近肿瘤区域。
通过单细胞微切割与蛋白质组学分析,研究人员发现肿瘤上皮区的巨噬细胞表现出典型的M2型免疫抑制表型,表明这些细胞在该区域可能通过形成免疫屏障抑制T细胞浸润,从而影响抗肿瘤免疫反应。这一发现有助于理解肿瘤免疫微环境的复杂性,并提示未来可能的免疫疗法方向。
结果3:
T细胞亚群在结直肠肿瘤微环境中具有独特的空间蛋白组学特征
在结直肠癌(CRC)的免疫微环境中,T细胞亚群(CTLs和TH细胞)在肿瘤上皮区与固有层(lamina propria)之间展现出独特的空间蛋白组学特征。
通过单细胞微切割和深度蛋白质组学分析,研究发现肿瘤上皮区(epithelial region)的CTLs表现出免疫激活相关通路的下调,细胞毒性减弱,而在固有层(lamina propria),它们则表现出增强的细胞毒性和免疫反应能力。
相较之下,肿瘤上皮中的TH细胞显示出与肿瘤适应、代谢重编程和免疫逃逸相关的通路上调,而固有层中的TH细胞则增强了抗原处理与呈递能力,表明其在免疫监视中发挥重要作用。
这些研究结果揭示了不同T细胞亚群在肿瘤微环境中的功能差异,为理解肿瘤免疫逃逸与进展提供了深刻的分子见解。
结果4:
细胞毒性T细胞与肿瘤细胞紧密接近
研究团队将mipDVP技术扩展到扁桃体癌FFPE切片,采用22-plex标记染色法,成功鉴定了肿瘤微环境中的关键细胞类型。
分析结果显示,57,276个细胞被归类为四个主要群体:肿瘤细胞、淋巴细胞、髓系细胞和内皮细胞,其中免疫细胞占43%。
空间分析显示,CTLs与肿瘤细胞的距离较近,表明其在肿瘤实质和基质中密集分布,可能促进肿瘤-免疫细胞的相互作用,提示该肿瘤为免疫热性(immunologically hot)。这些发现强调了肿瘤免疫环境的空间结构和细胞间相互作用对免疫疗法反应性的影响。
结果5:
CTLs对肿瘤增殖的抑制作用
研究发现,TIL-CTLs(肿瘤浸润的细胞毒性T淋巴细胞)不仅在肿瘤基质中富集,还位于肿瘤实质附近,与肿瘤细胞的距离较短,表明它们可能参与肿瘤免疫监视(immune surveillance)和抗肿瘤反应。
进一步分析显示,TIL-CTLs在肿瘤实质中的CD45RA和CD45RO标记表达缺失,提示其在TME内可能具有特化的功能适应。
空间分析表明,TIL-CTLs与肿瘤细胞之间的距离越近,肿瘤细胞的增殖越低(Ki67−/Ki67+比例较高)。这一现象可能表明TIL-CTLs在近距离作用区对肿瘤增殖有抑制作用,同时远离TIL-CTLs的肿瘤细胞表现出更高的增殖活动,提示肿瘤细胞的空间分布可能影响其免疫逃逸和增殖行为。
结果6:
肿瘤细胞的蛋白质组异质性与其同TIL-CTLs的距离相关
研究发现,肿瘤细胞根据其与CTLs的距离表现出不同的蛋白质组特征。通过主成分分析(PCA),肿瘤细胞根据与CTLs的距离分为近、中、远三组,且距离CTLs较近的肿瘤细胞与远离CTLs的肿瘤细胞在蛋白质组特征上存在显著差异。
接近CTLs的肿瘤细胞表现出干扰素和白介素-12信号通路的上调,表明这些肿瘤细胞响应CTLs的细胞毒性活性。相反,远离CTLs的肿瘤细胞则表现出与免疫监视相关的补体激活和吞噬作用等通路的上调,可能提示巨噬细胞和浆细胞等在肿瘤免疫监视中的作用。
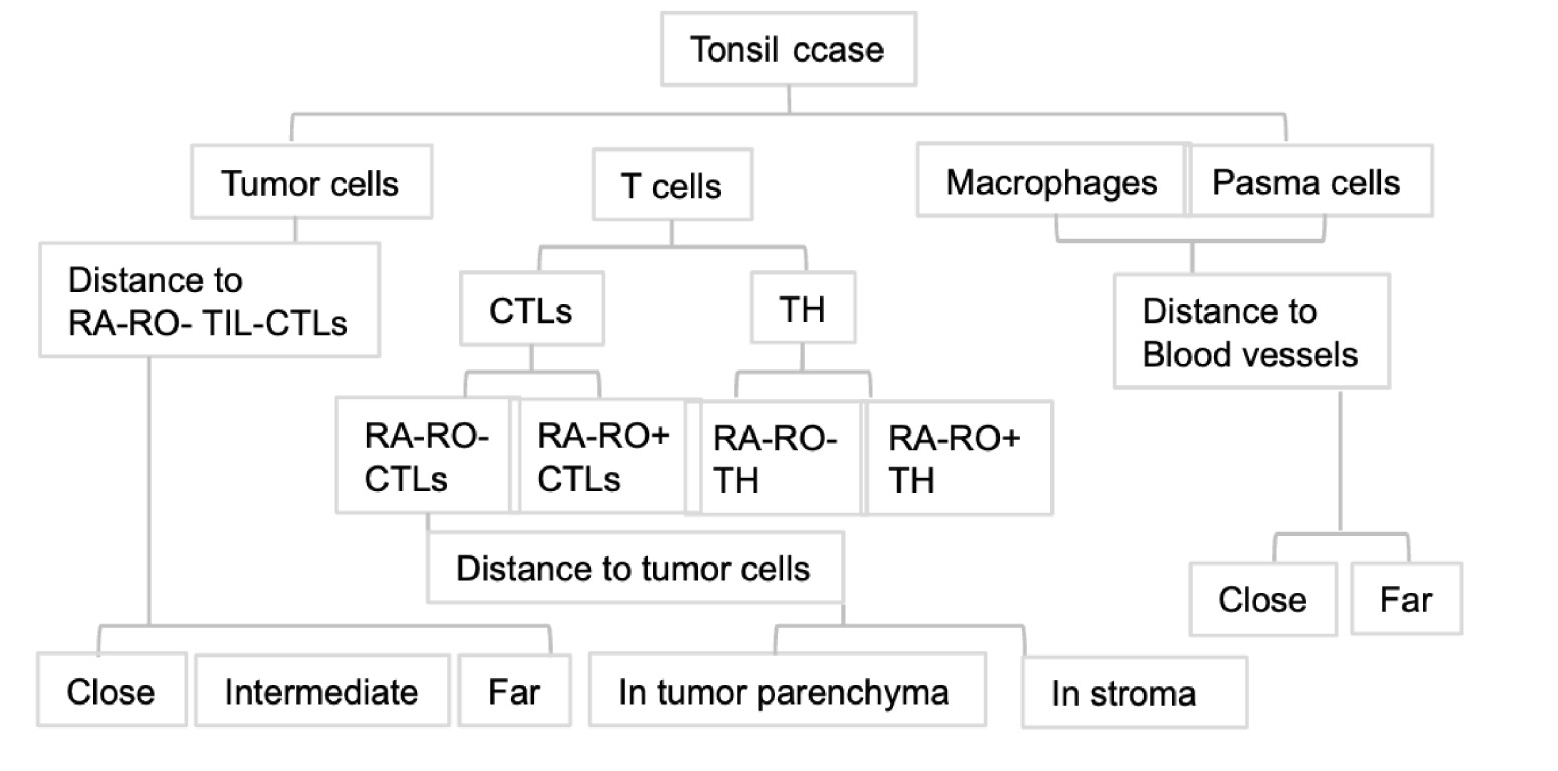
图4 从扁桃体癌组织中分离的细胞空间定位图,用于蛋白质组分析。
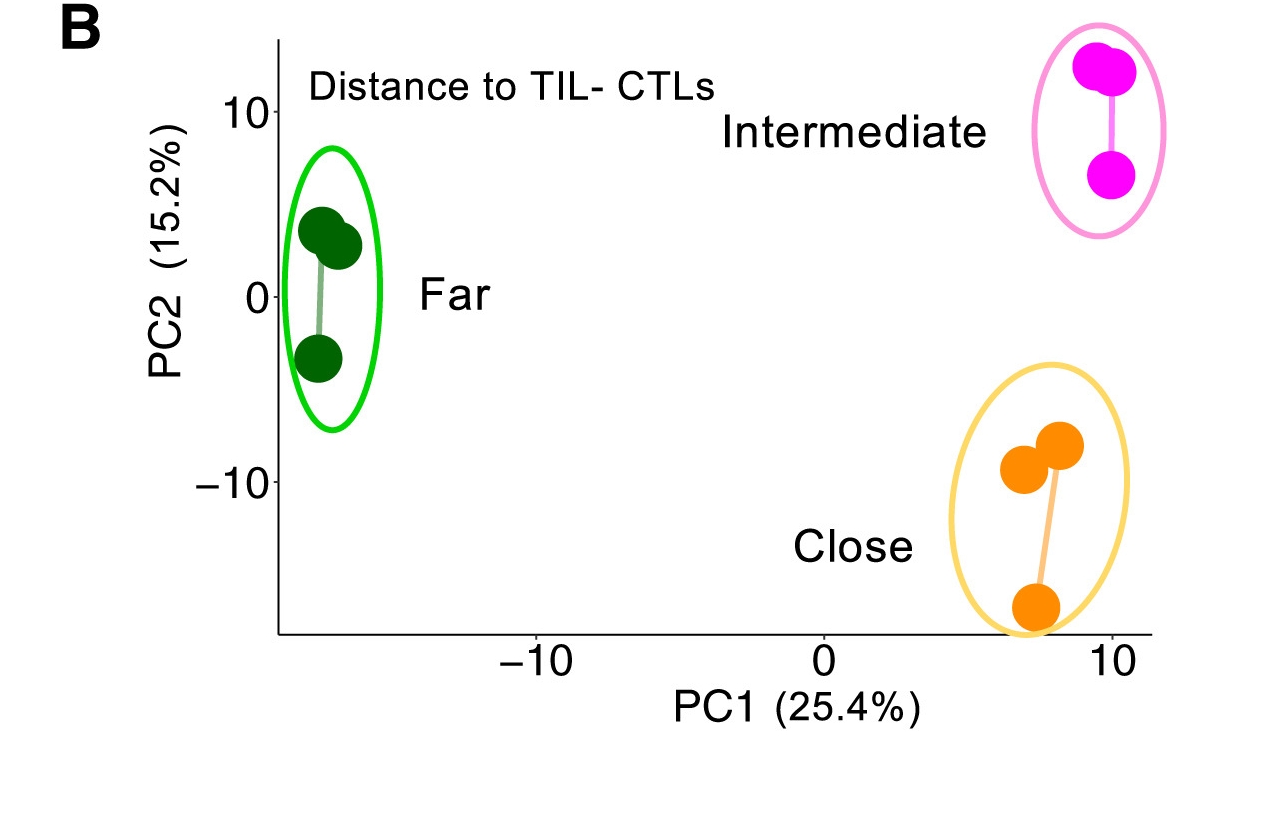
图5 通过主成分分析(PCA),肿瘤细胞根据与CTLs的距离分为近、中、远三组
结果7:
TIL-CTLs对低氧TME的战略性适应
研究发现TIL-CTLs表现出显著的蛋白质组变化,尤其在适应低氧环境方面,通过上调与低氧反应相关的分子(如ANXA1、GSTP1等),TIL-CTLs增强了其穿透肿瘤深部和低氧区域的能力,进一步支持其在肿瘤实质中的适应性。
与肿瘤细胞的空间关系分析表明,TIL-CTLs与肿瘤细胞之间存在积极的免疫应答,促进了对肿瘤的免疫监视。此外,免疫细胞与肿瘤细胞之间的配体-受体相互作用揭示了免疫细胞和肿瘤细胞之间的动态免疫调节网络,反映出肿瘤免疫监视与免疫调节之间的复杂交互。
本研究通过 mipDVP 技术实现的空间蛋白质组学分析,为解读肿瘤免疫微环境中的细胞相互作用、免疫逃逸机制和免疫治疗反应提供了新的视角。这项技术有望为个性化癌症免疫治疗策略的制定提供重要依据,并推动精准肿瘤学的发展。
该研究也存在样本量较小等局限性。未来的研究可能会扩展到检测蛋白质的翻译后修饰(如磷酸化、泛素化等),这些修饰对于蛋白质的功能、定位和相互作用具有重要调节作用。
西湖欧米空间蛋白组学「明星产品」
FAXP™ 单细胞和亚细胞器空间蛋白质组学
西湖欧米FAXP™( Filter-aided expansion proteomics, FAXP)结合了基于水凝胶的组织膨胀、滤膜辅助的样本制备流程和高分辨率 Orbitrap Astral 质谱,使得研究者可以在组织水平进行单细胞/亚细胞器分辨率的空间蛋白质表达分析。
应用场景
1 微量空间蛋白质组学
适用于目标区域直径在150 μm以上,且面积相对规则。
2 单细胞分辨率的空间蛋白质组学
3 亚细胞器分辨率(细胞核)的空间蛋白质组学
FAXP™ 技术详情:FAXP™️ 单细胞和亚细胞器空间蛋白质组学

西湖欧米现已推出FAXP™科研服务及商业化试剂盒,助力广大科研人员高分辨率空间蛋白组学分析,各位老师若感兴趣,欢迎垂询。









