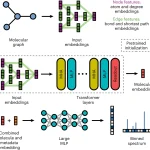
近期,异种器官移植领域接连发生 “大动作”:
3月10日,西京医院成功将一只多基因编辑猪的全肝以辅助的方式移植到一位脑死亡患者体内,这是全球首例由猪到人异种肝移植公开报道案例;一周多后,美国麻省总医院宣布完成了全球猪肾脏移植至人体的手术,一位深受肾病折磨的患者因此重获新生。
图1 外科医生移植猪肾 图源harvard.edu
日历再翻回到两年前:2022年1月,马里兰大学医学院宣布完成世界首例猪心脏人体器官移植。患者术后存活了两个月,这也成为了异种器官移植的里程碑。
医学技术发展到今天,已经可以试着将猪心、猪肝、猪肾移植到人体。但回顾器官移植的历史,还不足70年。
01
如何应对器官移植风险?
1954年,世界上第一例成功的器官移植手术在美国波士顿完成。诺奖得主、哈佛大学医学院的器官移植专家 Joseph Murray 将一名健康人的肾脏移植到其孪生兄弟体内。术后,病人得以长期存活。
无论同种还是异种,实体器官移植的历史都是现代医学最伟大的成功故事之一。自1954年首次在双胞胎之间成功进行肾移植以来,实体器官移植已发展为当前临床实践中终末期器官衰竭的首选治疗方法。
尽管移植手术的技术问题已经解决,但我们仍然面临相当大的免疫学挑战:所有移植患者都有出现并发症的风险。仅以同种异体移植而言,术后可能出现排斥和死亡。
目前,移植物活检的组织学分析仍然是评估同种异体移植物损伤的金标准,但仍存在有创性、并发症风险和成本等问题。
器官损伤或排斥反应的临床表现通常是非特异性的并且是晚期的。当前成功器官移植的要求是确定可靠、准确、针对疾病特异性、无创的方法来早期诊断移植物损伤或排斥。无创技术的发展对于进行常规随访非常重要,且不会带来与移植物活检相关的不适和风险。[1]
有没有无创和更快速的诊断方法,能更好更轻松地应对器官移植的风险问题?
02
蛋白质组学与器官移植
目前有多种方法诊断器官移植的排斥反应,其中,蛋白质组学研究是最重要的焦点之一。
在器官移植领域,蛋白质组学不仅旨在开发用于免疫监测的无创手段,而且旨在获得同种免疫反应病理生理学的机制见解,从而确定新的治疗靶点。[2]
2003年,约翰斯·霍普金斯大学医学院的研究团队首次报告了用于检测急性肾同种异体移植排斥的尿液生物标志物的无偏蛋白质组学方法。[3]
研究人员从32名肾移植患者身上采集了34份尿液样本,这些患者处于移植后的不同阶段,其中17名移植受者出现急性排斥反应,15名患者未出现排斥反应。对尿液样本进行蛋白组学分析后,研究人员选出了一批极具潜力的候选生物标志物,能区分无排斥反应和有急性排斥反应的患者。
他们表示,这些候选生物标志物是开发诊断急性排斥反应无创方法的基础,而不会产生与针刺活检相关的发病率和死亡率。
这一研究凸显了蛋白质组学在器官移植领域研究(尤其是移植排斥反应诊断)中的巨大潜力。
此后20年间,蛋白质组学越来越多地被应用到器官移植的同种异体排异反应以及排异反应相关生物标记物的发现。除了肾移植外,蛋白质组学在肝移植、心脏移植甚至角膜移植等领域都有了相应研究。
2011年,梅奥诊所胃肠和肝脏病科的研究人员首次对肝移植患者的急性细胞介导排斥反应(ACR)进行了差异蛋白质组学研究。[4]
在最初的非靶向研究中,研究人员从8名确诊术后ACR的患者和8名没有ACR的患者身上采集样本,发现排异组和对照组之间有41种蛋白质的表达存在显著差异。经过队列研究验证,补体成分(C)1q和C4是预测ACR的独立指标,且C4的预测能力尤其强。
2019年,中山大学附属第一医院器官移植中心的研究人员首次结合转录组学和蛋白质组学对肝脏缺血再灌注损伤(IRI)进行了全面研究。他们筛选了再灌注肝组织与移植前肝组织之间的差异表达蛋白,发现了10个核心调控蛋白/基因,揭示了肝脏IRI的关键因素。[5]
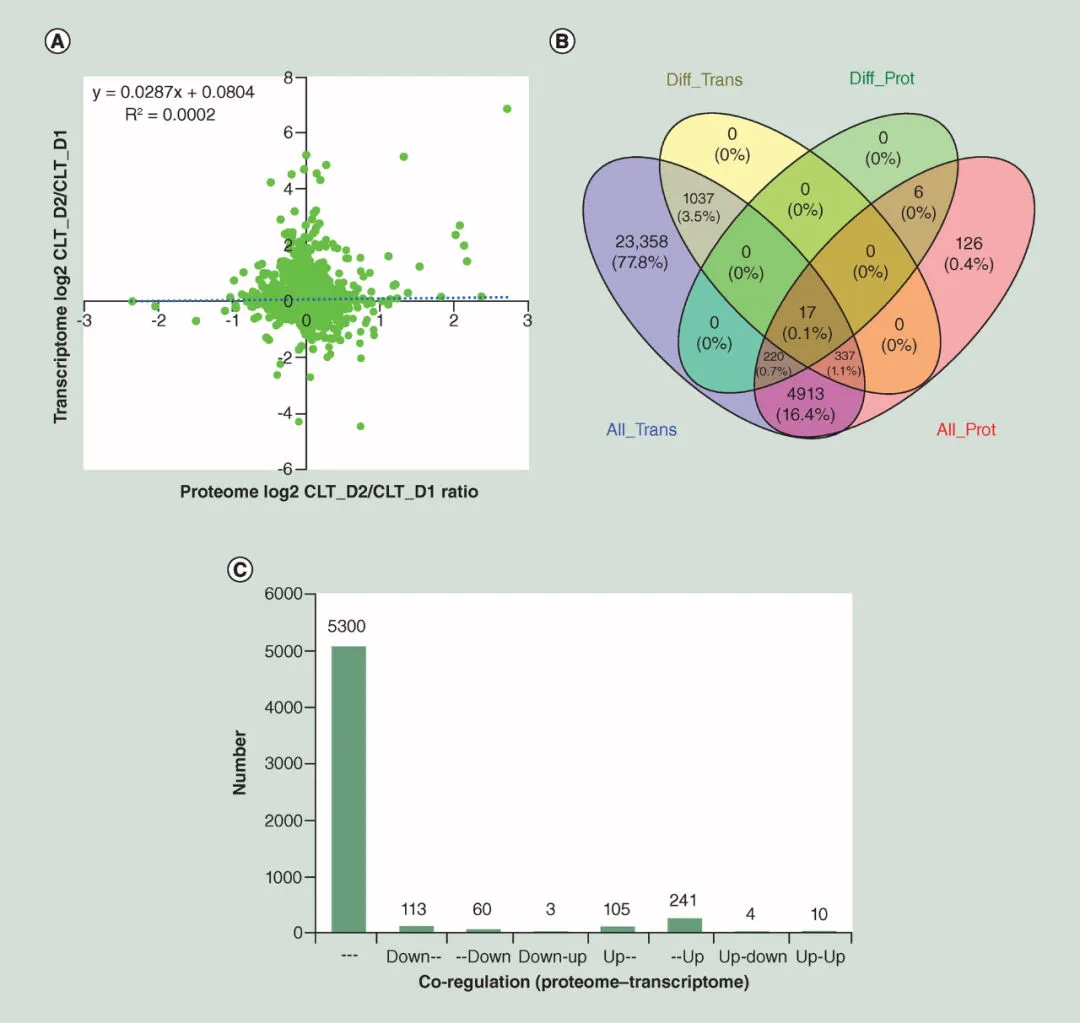
图2 转录组和蛋白质组相关分析 (A)转录组和蛋白质组关系的量化;(B)在蛋白质组和转录组数据中均发现了串扰;(C)蛋白质组和转录组中基因和蛋白质的差异调节。
2022年1月,美国西北大学的研究团队在 Science 发表了蛋白组学研究论文。他们绘制了人类血细胞蛋白图谱,并进一步研究了蛋白图谱的临床应用价值。[6]
图3 论文截图
通过对肝移植患者的外周血单核细胞蛋白图谱的应用,研究人员发现免疫细胞蛋白质中的新指标随着排斥反应而改变,鉴定出了有潜力预测肝脏移植排斥的生物标志物。
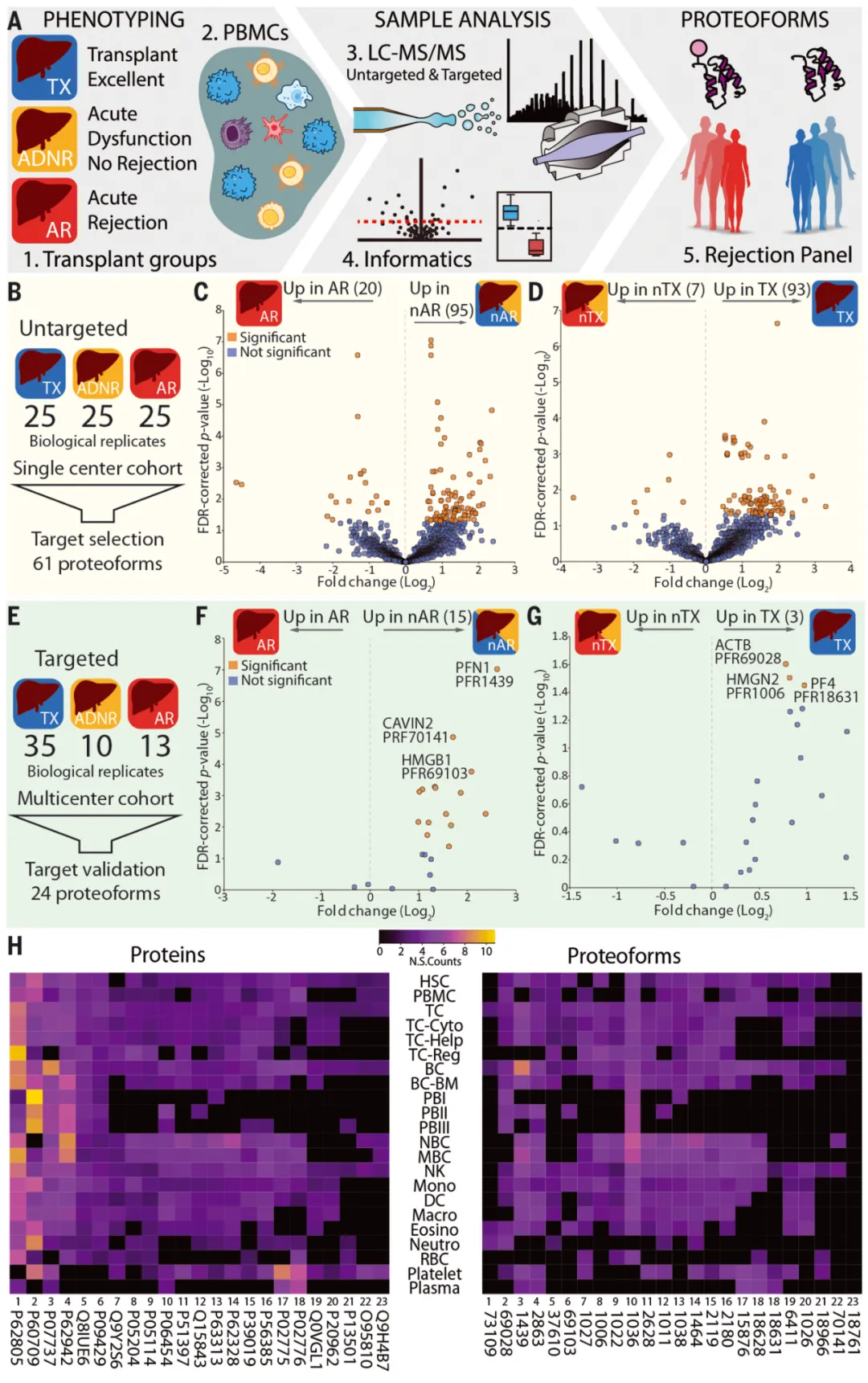
图4 对肝移植受者的PBMC蛋白质形式进行自上而下的定量蛋白质组学分析
再来看看蛋白质组学在心脏和角膜移植中的一些研究。
在心脏移植中,最严重的长期并发症之一是心脏移植物血管病(CAV)。
早在2005年,就有英国国家心肺研究所的研究人员比较了无CAV的长期心脏移植幸存者和移植后3年内出现CAV的患者的活检样本。结果表明,在无CAV患者的活检样本中,热休克蛋白27(HSP27)的特异性二磷酸化形式的斑点强度增加了20倍,并得出结论:热休克蛋白27的血管表达与无CAV有关。[7]
2021年,赫尔辛基大学的研究团队对脑死亡多器官捐献者的血浆样本进行了无标记蛋白质定量分析,首次证明了脑死亡供体具有独特但异质性的蛋白质组特征。[8]
研究人员使用无监督和监督统计模型确定脑死亡供体与健康对照之间的蛋白质组差异,分析了蛋白质组变异和相应的生物通路,并将其与移植结果联系起来。研究结果表明,脑死亡会明显改变血浆蛋白质组特征,而与内皮细胞和心肌细胞功能、炎症、血管生长和动脉生成相关的供体血浆蛋白质变化可预测移植结果,这表明它在供体评估中发挥着作用。
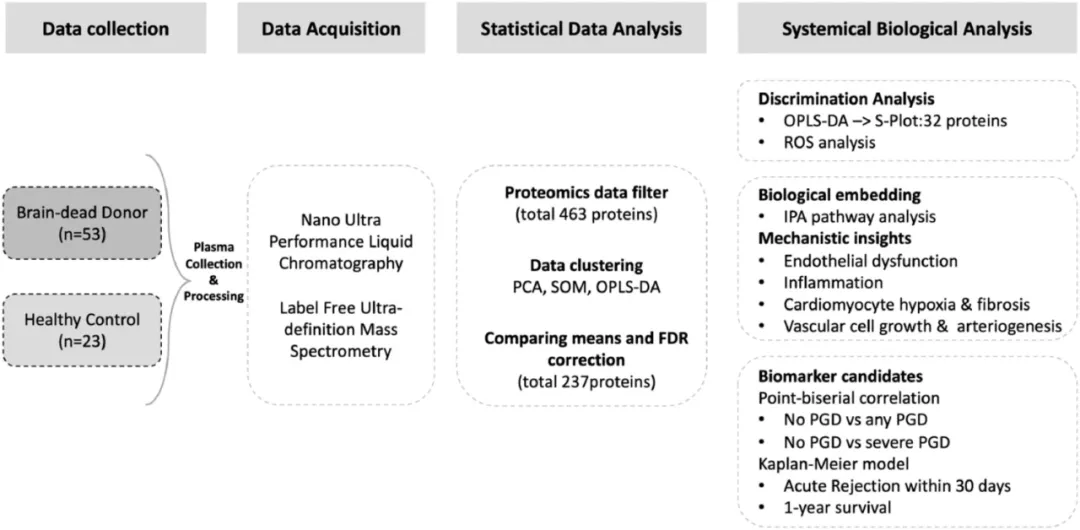
图5 研究设计
今年2月,首尔国立大学医学院和得克萨斯A&M大学医学院的研究人员利用血清小细胞外囊泡(EVs)的蛋白质组学分析来预测了小鼠角膜移植的排斥反应。[9]
研究人员对有排斥反应移植受者和无排斥反应移植受者EVs的蛋白质组学特征进行比较分析后发现,排斥反应者第7天的EVs中组织相容性复合体2(histocompatibility 2)、Q区基因座2明显富集;相比之下,非排斥者第7天EVs中的血清淀粉样蛋白 A2(一种因损伤而诱导的蛋白质)有所增加。研究结果提供了基于EVs的非侵入性潜在生物标志物,可用于预测角膜同种异体移植排斥或耐受。
近些年来,蛋白质组学技术越来越多地被应用于器官移植方面研究,为移植急慢性排斥反应的诊断提供了无创方法。同时,蛋白质组学也是评估慢性移植疾病、移植术后感染及患者预后的有效手段,具有广阔的应用前景。
然而,蛋白质组生物标志物从实验室到临床的 “转移” 是一个巨大的挑战,只有少数移植研究超出了生物标志物开发的发现阶段。到目前为止,尚未发现任何候选生物标志物已成为可靠的临床诊断工具。
在未来,这一领域还需要包括更大患者队列在内的临床研究来统计识别稳健的临床生物标志物。而随着异种器官移植技术的发展和推广,器官移植领域又多了一道需要合力迈过的坎,蛋白质组学在其中的潜能也正等着科学家们去开拓。
路漫漫其修远兮,蛋白质组学与器官移植这对cp还有很长、很难的路要走。
参考文献:
1. Zubair, Haseeb PhD1; Azim, Shafquat PhD1; Maluf, Daniel G. MD2; Mas, Valeria R. MS, PhD, FAST1; Martins, Paulo N. MD, PhD, FAST, FEBS, FACS3. Contribution of Proteomics in Transplantation: Identification of Injury and Rejection Markers. Transplantation 107(10):p 2143-2154, October 2023.
2. Katrin Kienzl-Wagner, Gerald Brandacher, Chapter Six - Proteomics in Transplantation, Editor(s): Gregory S. Makowski, Advances in Clinical Chemistry, Elsevier, Volume 67, 2014, Pages 215-244
3. Clarke, William PhD†; Silverman, Benjamin C. BS†; Zhang, Zhen PhD†; Chan, Daniel W. PhD†; Klein, Andrew S. MD*; Molmenti, Ernesto P. MD, PhD*. Characterization of Renal Allograft Rejection by Urinary Proteomic Analysis. Annals of Surgery 237(5):p 660-665, May 2003.
4. Massoud O, Heimbach J, Viker K, Krishnan A, Poterucha J, Sanchez W, et al. Noninvasive diagnosis of acute cellular rejection in liver transplant recipients: a proteomic signature validated by enzyme-linked immunosorbent assay. Liver Transpl. (2011) 17(6):723–32.
5. Huang, Shanzhou et al. “Comprehensive and combined omics analysis reveals factors of ischemia-reperfusion injury in liver transplantation.” Epigenomics vol. 11,5 (2019): 527-542.
6. Rafael D. Melani et al. ,The Blood Proteoform Atlas: A reference map of proteoforms in human hematopoietic cells.Science375,411-418(2022).
7. De Souza, A I et al. “Heat shock protein 27 is associated with freedom from graft vasculopathy after human cardiac transplantation.” Circulation research vol. 97,2 (2005): 192-8.
8. Lukac, Jan et al. “Plasma proteome of brain-dead organ donors predicts heart transplant outcome.” The Journal of heart and lung transplantation : the official publication of the International Society for Heart Transplantation vol. 41,3 (2022): 311-324.
9. Lee, Hyun Ju BS1,2; Bae, Eun-Hye PhD3; Choi, Jong Min PhD4; Kim, Hyemee PhD3; Kim, Hyeon Ji BS1,2; Barreda, Heather BS3; Jung, Sung Yun PhD4; Oh, Joo Youn MD, PhD1,2; Lee, Ryang Hwa PhD3. Serum Extracellular Vesicle Protein Profiling for Prediction of Corneal Transplant Rejection. Transplantation ():10.1097/TP.0000000000004946, February 27, 2024.