研究背景及简介
缺血性卒中具有高发病率、高致死致残率等特点,其致病机制错综复杂,临床上防治困难,严重危害我国居民健康。近些年研究发现,小细胞外囊泡(Small extracellular vesicles, sEVs)具有细胞主动分泌、携带蛋白质和核酸信息、在细胞之间进行信息传递的特性,不仅参与了多种疾病的发生发展进程,还因其能透过血脑屏障、免疫原性低、稳定性高等特点逐步被用于中枢神经系统疾病的诊断和治疗。
然而很少有研究调查了在缺氧条件下神经元来源的sEVs的性质和内容物成分。这些丰富的sEVs在缺血性卒中的发生和发展中的参与程度仍然是一个悬而未决的问题。
2023年7月16日,暨南大学附属第一医院徐安定/逯丹/麦鸿成团队在Bioactive Materials上发表了题为FUS-mediated HypEVs: Neuroprotective effects against ischemic stroke 的研究论文,该研究利用体外缺氧复灌原代神经元释放的缺氧sEVs为研究对象,通过蛋白组学和转录组学全面系统地阐述缺氧神经元sEVs的特征和组分,并深入分析其在调节缺血性卒中细胞间互作的潜在作用和机制。

研究样本
(1)样本类型:小鼠,细胞,sEV。
(2)组学方法:TMT蛋白质组学,RNA测序。
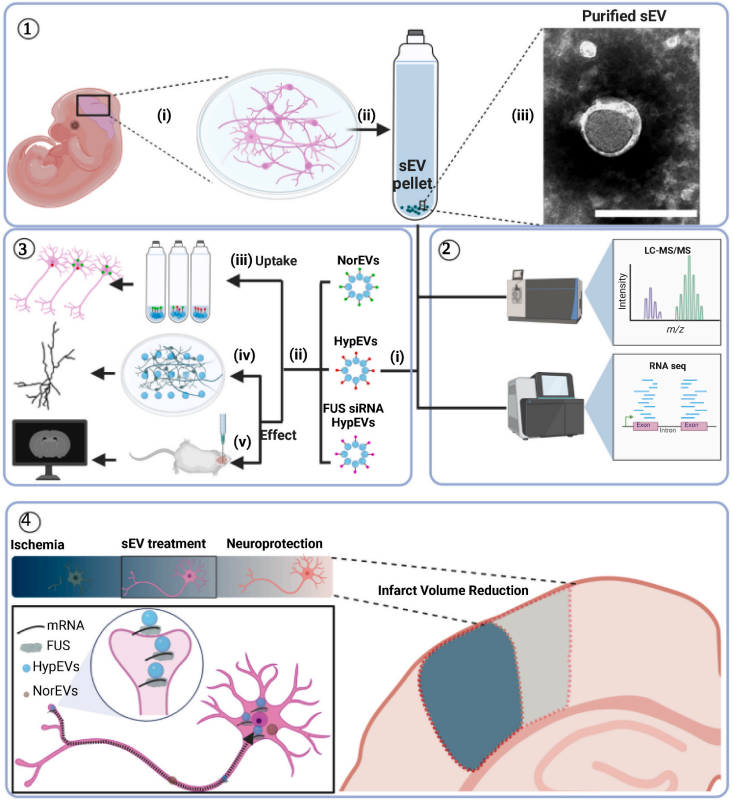
图1. 皮质神经元衍生的sEV提取、表征和神经保护分析的示意图。① 原代皮层神经元sEVs的提取及鉴定;② 原代神经元sEVs蛋白组学和转录组学分析;③ 原代神经元sEVs体内外摄取效率、神经保护作用的差别,及FUS对sEVs作用的影响;④ 含FUS-mRNA的神经元缺氧sEVs更容易被摄取利用,其由神经末梢进入受体神经元并触发神经保护作用。
研究结果
1.缺氧可刺激神经sEVs的释放和摄取
缺血性卒中发生时,梗死周边微环境中接受着来源于正常神经元释放的sEVs以及缺氧神经元释放的sEVs。为了比较两者sEVs的区别,作者在体外培养原代皮层神经元,提取细胞上清sEVs做了蛋白组学和转录组学研究。
作者首先对两者sEVs的物理特性和摄取效能做了比较。结果发现两者sEVs在外观及大小上区别不大,但同等神经元数目下缺氧sEVs(Hypoxic sEVs, HypEV)分泌量更多,相差两倍及以上。此外体内滴鼻给药时发现HypEV相比于常氧sEVs(normoxic sEVs, NorEV)更容易被梗死周边区神经元摄取利用。
在体外共培养实验中,同样发现HypEV更加容易进入到受体神经元当中,在胞体周围聚集。
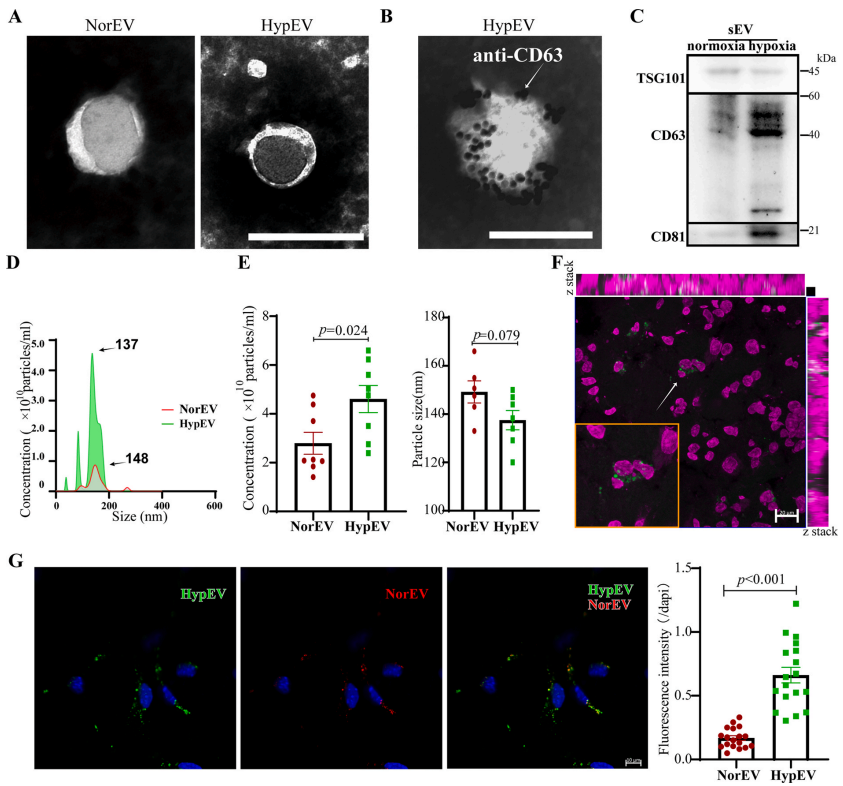
图2. 研究皮层初级神经元在正常和缺氧应激条件下释放sev的特征。
2. 蛋白质组学分析显示神经元来源的FUS上调HypEVs
进一步,对两者sEVs(n=3)做了TMT定量蛋白组学分析,结果鉴定出4585个蛋白,GSEA分析发现BP前10个富集基因集的结果表明,sEV蛋白与细胞氧化磷酸化、mRNA代谢和突触组装有关;CC结果表明,蛋白质主要位于线粒体、质膜和突触膜;MF的结果表明,蛋白质的功能与RNA结合和翻译调控有关。热图显示了上调及下调的前30个蛋白(HypEV vs. NorEV),其中上调蛋白富集出RNA结合相关蛋白通路,而下调蛋白中未发现有蛋白互作通路。
GO和KEGG分析显示这些RNA结合蛋白(RNA binding protein, RBP)与mRNA结合、代谢和神经退行性疾病有关。此项研究中鉴定了七种RBP相关蛋白,其中FUS是HypEVs中最丰富和持续富集的蛋白质。
通过三次生物学重复筛选出显著高表达的、在PPI网络中占核心位置的、与神经系统疾病密切相关的RBP FUS。FUS分别排在第1、第4、第15位,且western blotting证实FUS在神经元分泌的HypEV中显著高表达。
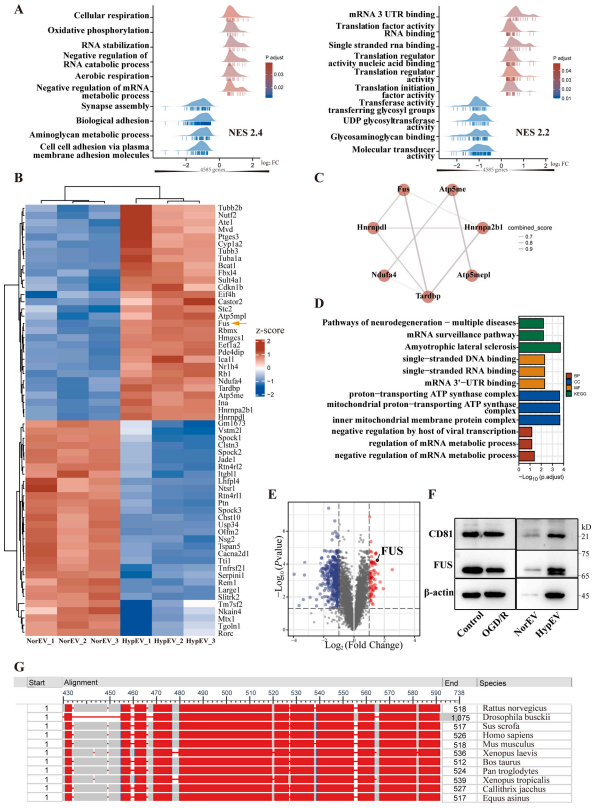
图3. 常氧和缺氧条件下神经元释放sEV的蛋白质组学分析。
3. HypEV有助于维持神经元形态和神经突起
紧接着通过在体内外实验中比较了两者sEVs对缺血损伤的神经元的作用。结果发现,HypEVs在缺血性损伤后对神经元发挥了有益的保护作用,并且这种作用在HypEVs中比NorEVs更强。
HypEV可以保护神经突起的长度、数量、复杂度,可以减轻OGD/R损伤导致的突触蛋白丢失,可以增强神经元蛋白合成能力,减轻树突棘的丢失,减小小鼠脑梗死体积(18.0 ± 3.5 mm³ with PT vs. 9.8 ± 2.6 mm³ with HypEV treatment)。
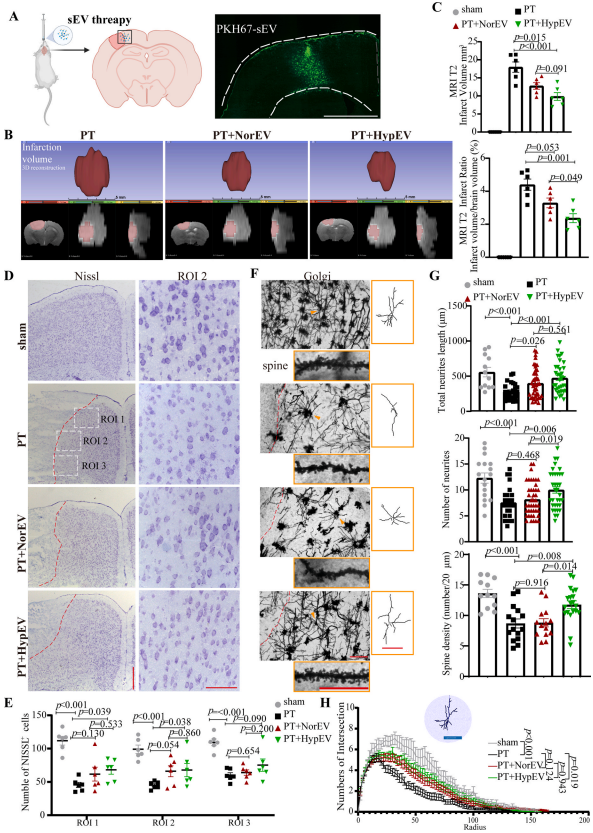
图4. HypEVs在体内的作用。
4. 敲低FUS可降低PT脑卒中的HypEV神经保护作用
RBP稳态对于中枢神经系统至关重要,RBP失衡可以导致神经退行性疾病发生。RBP参与了RNA的合成、转运、代谢、定位和翻译等等。
作者通过在原代神经元转染FUS siRNA和构建FUSKO、FUSKO+OE稳转株调控HypEV中FUS的含量,论证了FUS是HypEV发挥神经保护作用必不可少的蛋白。
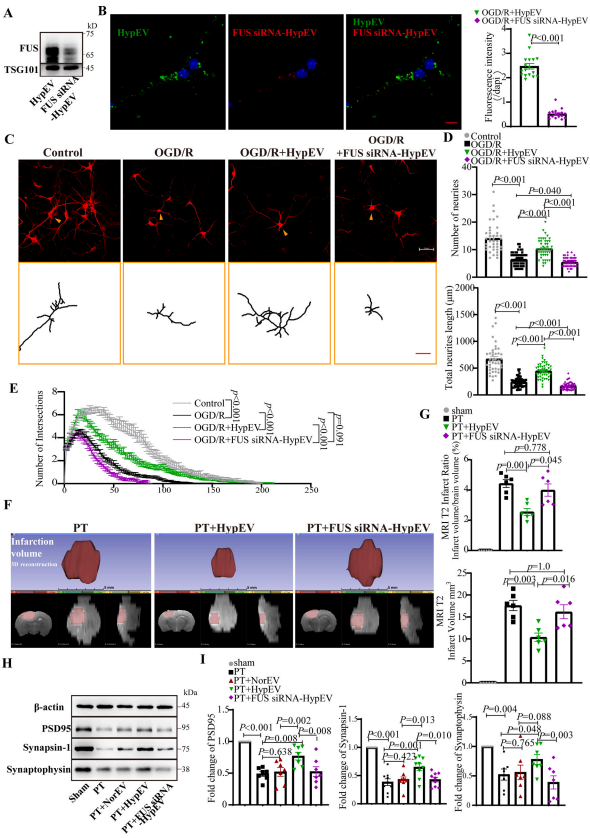
图5. 在体外和体内,敲除FUS可降低HypEVs的神经保护作用。
5. FUS通过HypEV介导线粒体mRNA转运
FUS是HypEVs中高表达的蛋白质,在DNA修复、RNA加工和转运以及RNA稳定等各种生理过程中起着至关重要的作用,作者接着对两者sEVs做了转录组学分析,鉴定出209个上调mRNA(log2FC ≥ 1)。
上调的mRNA的GO和KEGG富集分析显示,上调mRNA与细胞呼吸、呼吸电子传递链高度相关,且大都是线粒体mRNA。作者挑选了5个显著上调的mRNA验证了mRNA测序的结果。
同时通过预测发现了FUS与线粒体mRNA的结合,并进一步通过FUS敲低实验和RBP免疫共沉淀(RBP immunoprecipitation, RIP)论证了FUS参与了线粒体mRNA经缺氧sEVs分泌到细胞外的过程。FUS敲低降低了FUS sirna - hypev中线粒体mRNA的丰度,同时在亲本细胞和缺氧sEVs的RIP实验中显示FUS能够拉下线粒体mRNA。
接着利用ACTD抑制受体细胞内源性mRNA的合成,证实了经sEVs转运的线粒体mRNA能被翻译成蛋白。进一步地,作者检测了受体神经元的线粒体电镜、细胞活性和线粒体相关凋亡,发现存在于HypEV中的FUS在运输线粒体mRNA和减少受体神经元凋亡中起关键作用。
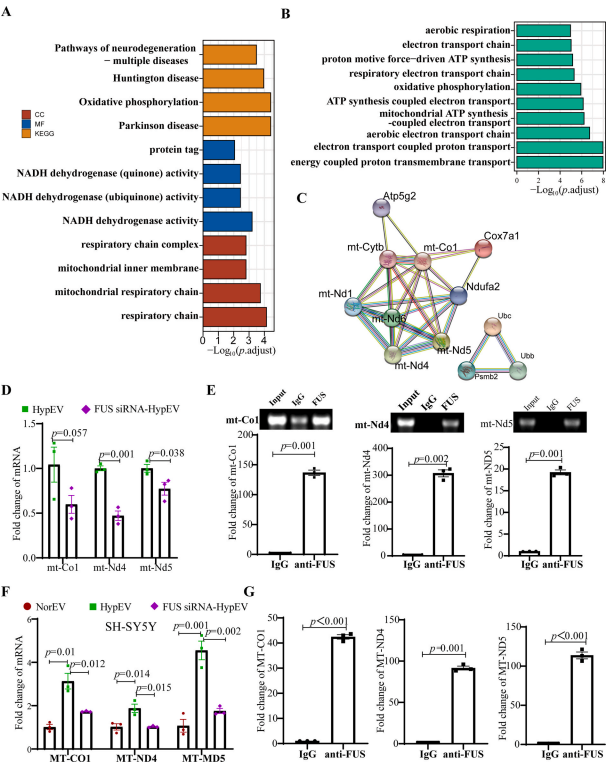
图6. FUS通过hypev介导线粒体mRNA转运。
文章小结
这项研究为缺氧条件下神经元释放的sEV对缺血性中风的调节提供了新的见解,系统地论证了原代神经元中RNA结合蛋白经缺氧sEVs转运mRNA的过程,为HypEVs介导的神经保护机制提供了重要的见解,并强调了基于HypEVs的缺血性损伤干预的潜在治疗应用。
文章链接:https://www.sciencedirect.com/science/article/pii/S2452199X23002141









