阿尔茨海默症(AD)的春天,是否快要来临?
8月7日,Nature 发表了一篇 News Feature,讨论了AD血液检测的最新进展以及其对疾病早期检测和治疗的潜在影响。文章指出,血液检测很快就能预测罹患阿尔茨海默症的风险!
作为一种常见的神经退行性疾病,AD已成为全球医学研究的焦点。近年来,蛋白质组学的快速发展为揭示AD的早期诊断、生物标志物和病理机制提供了强大的工具。通过系统分析脑脊液和血浆中的蛋白质组学数据,并结合分子亚型、翻译后修饰和蛋白质相互作用网络的研究,我们可以更深入地理解AD的发病过程,并发现潜在的治疗靶点。
今天,我们将介绍AD的几项高影响力研究,涵盖早期诊断和生物标志物预测、分子亚型与个性化医疗、疾病机制的比较与共同特征,以及翻译后修饰与疾病机制,旨在为临床研究者提供新的研究思路和实践指导。
01
早期诊断和预测生物标志物
AD的早期诊断和疾病预测是神经科学研究中至关重要的挑战之一。
通过对脑脊液和血液中的蛋白质组学进行深度分析,研究者们不仅在生物标志物的发现和验证方面取得了重大进展,还为早期干预和治疗提供了新的可能性。
以下研究通过机器学习和高通量蛋白质组学技术,识别出有助于AD早期诊断和疾病进展预测的关键分子,为临床应用提供了新的工具和靶点。
案例1
The Innovation|大规模脑脊液和血清蛋白质组分析揭示AD早期诊断和分期生物标志物

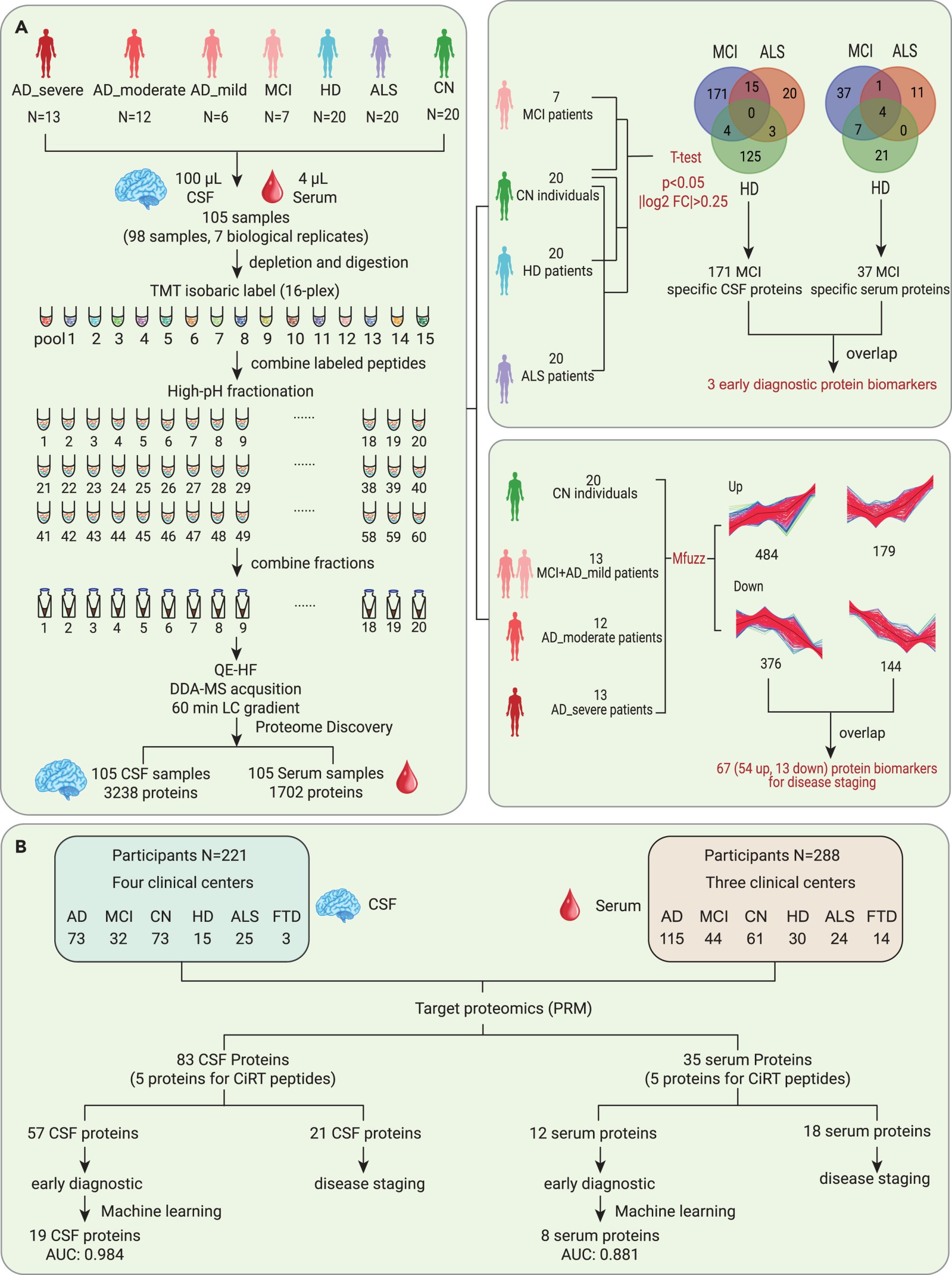
2024年1月2日,浙江大学吴志英团队、西湖大学郭天南团队和首都医科大学附属宣武医院贾建平团队在 The Innovation 发表AD蛋白质组学研究,通过机器学习开发了用于AD早期诊断的19种脑脊液蛋白和8种血清的蛋白质panel,且验证了21种脑脊液和18种血清的核心的AD阶段依赖性失调蛋白。
研究对由 98 名参与者组成的发现队列中的配对脑脊液(CSF)和血清样本进行了TMT蛋白质组学分析。在一个由 288 名参与者组成的独立多中心队列中,通过基于PRM的靶向蛋白质组测定验证了候选生物标志物。对发现队列中的 3,238 个 CSF 蛋白和 1,702 个血清蛋白进行了定量分析,分别确定了 171 个和 860 个 CSF 蛋白以及 37 个和 323 个血清蛋白为潜在的早期诊断和分期生物标记物。
在验证队列中,分别有 58 和 21 种 CSF 蛋白以及 12 和 18 种血清蛋白被确认为早期诊断和分期生物标记物。通过机器学习分别建立了19种脑脊液蛋白和8种血清蛋白生物标记物panel,可以准确地将AD导致的轻度认知障碍(MCI)与正常认知障碍进行分类,该panel也能有效区分AD导致的MCI患者和其他神经退行性疾病患者。
西湖欧米负责该研究的生信分析工作。
案例2
Nat Hum Behav | 脑脊液蛋白质组学揭示AD诊断和预测生物标志物

2024年7月10日,复旦大学类脑智能科学与技术研究院程炜研究员团队联合复旦大学附属华山医院郁金泰教授团队,在 Nature Human Behaviour 上发表了蛋白质组学最新研究,探索了通过多重脑脊液(CSF)蛋白质组学识别诊断和预测阿尔茨海默病(AD)的生物标志物。
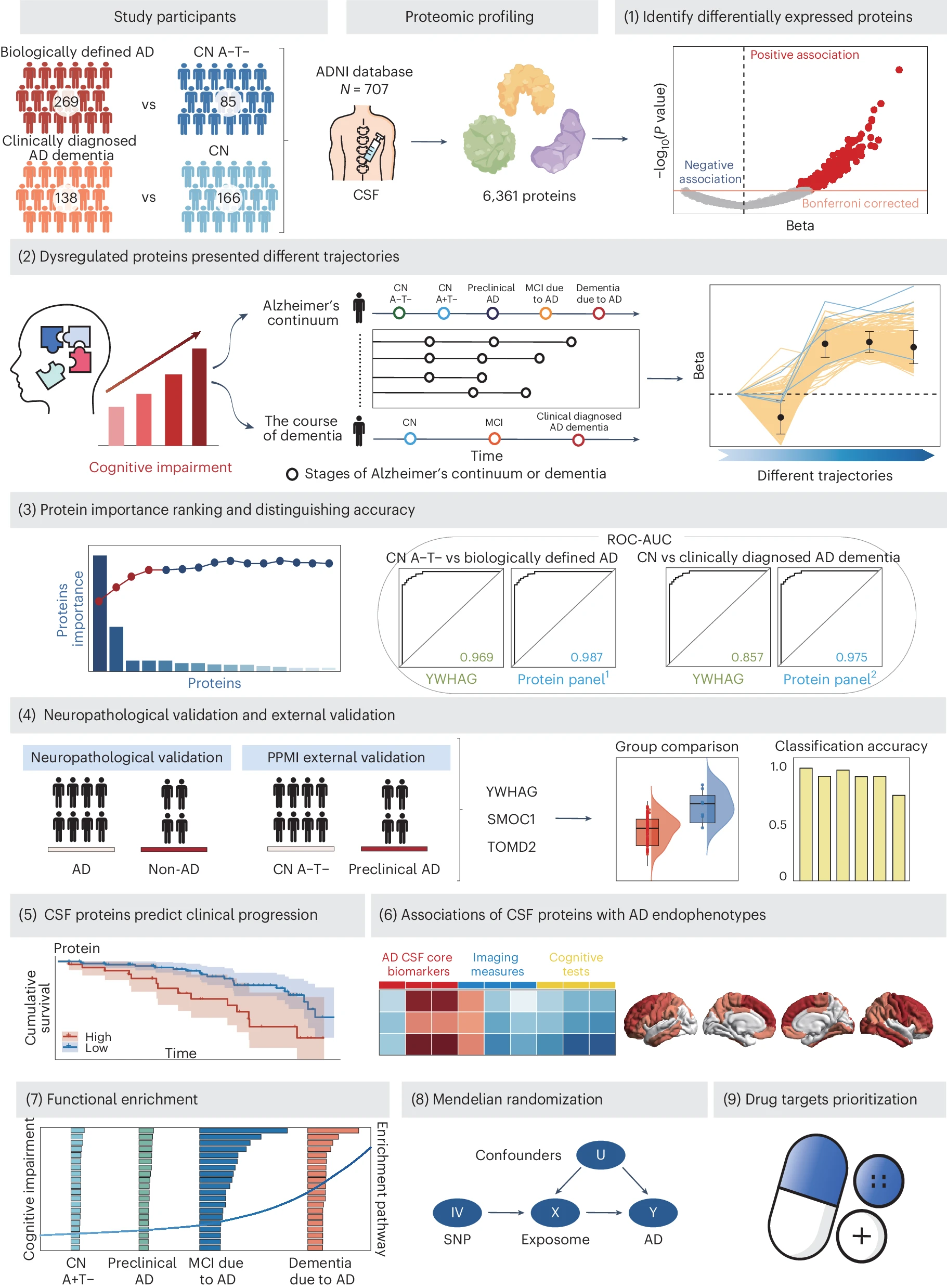
本研究是迄今为止最高通量的CSF蛋白质组学研究。研究探讨了八种蛋白质(YWHAG、SMOC1、PIGR、TMOD2、ACHE、PCSK1、MMP10和IRF1)在阿尔茨海默病(AD)中的表现和诊断潜力。
研究结果显示,YWHAG、SMOC1和TMOD2在尸检确认的AD患者中显著上调,并在独立外部队列中进一步验证其区分临床前AD的能力。这些蛋白质的高水平还与认知正常(CN)个体向临床前AD及轻度认知障碍(MCI)患者向临床AD痴呆转换的风险增加相关。
纵向分析显示,这些蛋白质与AD特异性生物标志物、神经退行性变化和认知测试显著相关,尤其在 four-protein panel 和 five-protein panel 中表现突出。此外,虽然部分蛋白质在名义显著性水平上与AD风险相关,但未通过多重检验校正。这些发现为AD的早期诊断和潜在治疗靶点提供了新的见解。
尽管AD是最常见的痴呆类型,但其他痴呆类型也同样值得关注。
下面这篇文章中,研究人员通过分析血浆蛋白质组学数据,预测了健康成人未来患痴呆症的风险。其研究方法和发现不仅为痴呆症的早期筛查和风险评估提供了重要的参考价值,也对AD的研究者具有重要的借鉴意义。
案例3
Nature Aging | 血浆蛋白质组学特征预测健康成人未来痴呆症

2024年2月12日,复旦大学附属华山医院郁金泰教授团队,联合复旦大学类脑智能科学与技术研究院冯建峰院长、程炜研究员团队,在 Nature Aging 发文,利用血浆蛋白质组预测了未来痴呆的风险。
研究基于UK Biobank中52,645名无痴呆的成年人数据。通过对1,463种血浆蛋白进行分析,研究发现GFAP、NEFL、GDF15和LTBP2与痴呆的发生显著相关,其中GFAP在预测全因痴呆(ACD)、阿尔茨海默症(AD)和血管性痴呆(VaD)中的表现尤为突出。结合GFAP(或GDF15)与人口统计数据后,模型的预测准确性显著提高,AUC分别达到0.891(ACD)、0.872(AD)和0.912(VaD)。
研究还发现,GFAP和NEFL的水平在痴呆诊断前至少10年开始上升,高GFAP水平的人群患痴呆的风险增加2.32倍。此外,GFAP和LTBP2在痴呆预测中特异性较高,GFAP被认为是预测痴呆的最佳生物标志物,具有重要的临床应用潜力,可用于高危人群的筛查和早期干预。
02
分子亚型与个性化医疗
个体化医疗的核心在于深入理解疾病的分子异质性,尤其是在AD这样复杂的疾病中。
下面两篇文章,通过分析患者的脑脊液蛋白质组学数据,研究者们揭示了AD的不同分子亚型,这些亚型不仅与患者的遗传风险和病理特征密切相关,而且可能在个性化治疗中具有重要应用潜力。这些研究探讨了如何根据分子亚型优化AD的治疗策略,为精准医疗奠定了基础。
案例1
Nature Aging|AD患者脑脊液蛋白质组学揭示具有不同遗传风险特征的五种分子亚型

2024年1月9日,阿姆斯特丹阿尔茨海默症研究中心的 Betty M. Tijm 团队在 Nature Aging 发文,通过质谱蛋白质组学分析了609名受试者的脑脊液(CSF)样本,检测了超过3000种蛋白质,揭示了阿尔茨海默病(AD)的五个分子亚型。
每个亚型与特定的分子过程相关,包括神经元增生(TREM2 R47H突变携带者比例较高)、先天免疫激活、RNA调控异常、脉络丛功能障碍和血脑屏障受损。研究还发现这些亚型在临床结果、生存时间和脑萎缩模式上存在显著差异,表明AD的分子异质性可能需要个性化治疗策略。
案例2
Transl Neurodegener|脑脊液蛋白组学鉴定AD源性轻度认知障碍的病理生理学亚型

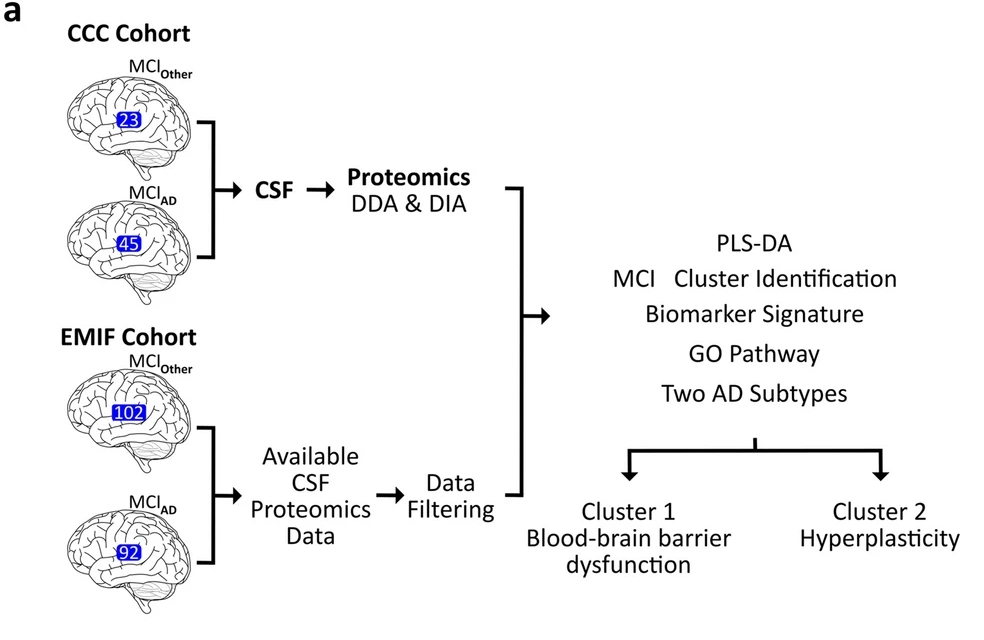
2024年4月9日,葡萄牙科英布拉大学的研究团队在 Translational Neurodegeneration 发表 Letter,通过脑脊液蛋白组学研究探讨了早期阿尔茨海默病(AD)患者的病理生理学亚型。
该研究招募了AD源性轻度认知障碍(MCIAD)患者和无Aβ沉积或神经损伤生物标志物的MCI患者(MCIOther)作为对照组,以控制可能影响MCI患者脑脊液蛋白组的非特异性变化。
通过蛋白质组学分析,研究人员发现了MCIAD和MCIOther患者之间的蛋白组差异,并成功将它们区分开来。进一步的非负矩阵分解聚类分析揭示了MCIAD患者内部的两个亚型,分别描述为血脑屏障功能障碍(Cluster 1)和高增殖性(Cluster 2)。这两个亚型在不同的队列中都显示出了类似的生物学过程,但在个体蛋白的选择上存在差异。研究的限制包括CCC队列中参与者数量相对较小,但其优点包括与其他国家的独立队列进行结果复制。
总体而言,该研究揭示了MCI阶段AD患者出现了两种主要的亚型,这对临床试验的设计和解释可能具有重要意义,因为治疗反应可能与患者所属的特定AD亚型相关。
03
疾病机制的比较与共同特征
不同神经退行性疾病之间是否存在共同的疾病机制?这一问题一直是神经科学研究的焦点。
通过比较AD、癫痫以及路易体痴呆(LBD)的蛋白质组学特征,研究者们揭示了这些疾病之间的相似性与差异。以下研究展示了AD与其他神经退行性疾病在疾病机制上的共同特征,并通过特异性蛋白质表达模式,深入探讨了各自独特的病理生理机制。
案例1
Acta Neuropathol|AD和癫痫中相似的脑蛋白质组学特征

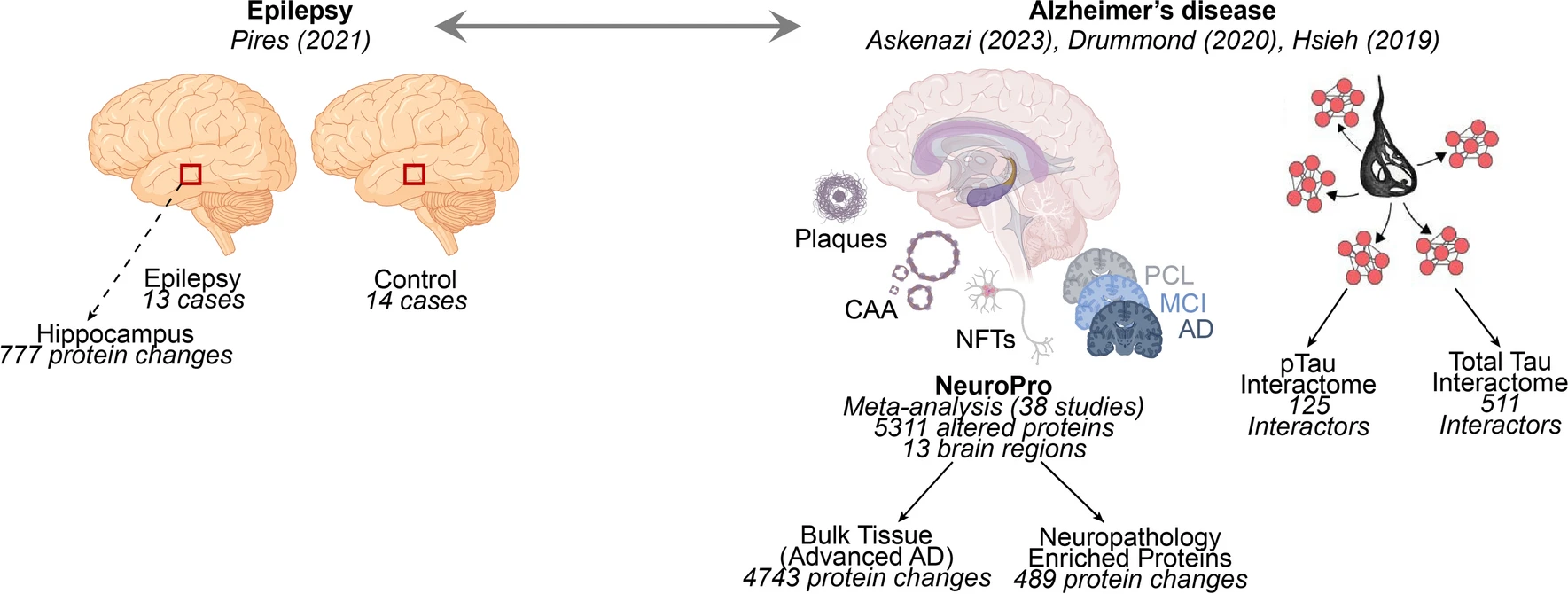
2024年1月30日,纽约大学格罗斯曼医学院的研究团队在 Acta Neuropathologica 发文,研究了阿尔茨海默病(AD)与癫痫之间的蛋白质组学相似性。
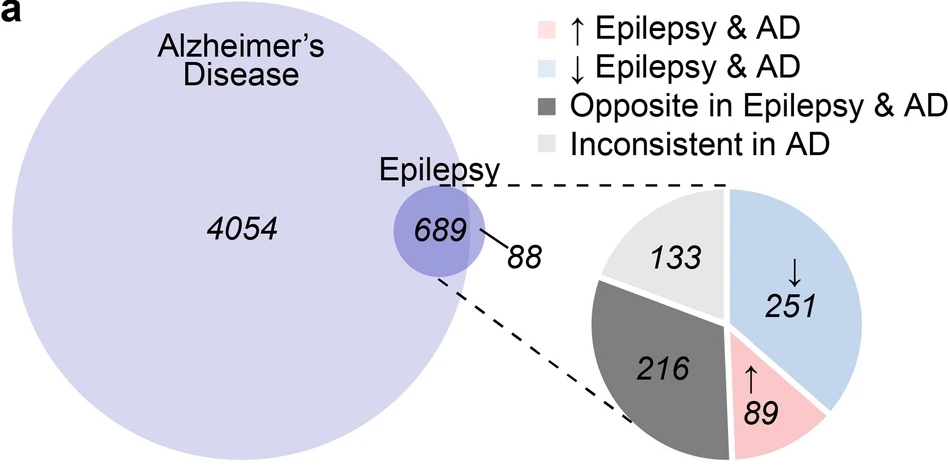
研究发现,癫痫患者海马中显著改变的777种蛋白质中有89%(689种)在晚期AD中也显著改变,其中340种蛋白质在两种疾病中变化方向一致,216种方向相反。尤其是突触和线粒体相关蛋白质在两种疾病中均显著减少,提示它们可能存在共同的疾病机制。相反,核糖体蛋白在癫痫中增加,而在AD中减少,显示了不同的分子机制。
研究进一步探讨了tau蛋白在两种疾病中的作用。在癫痫患者的海马切片中,免疫组化分析显示pTau217和pTau231的细胞内水平有增加趋势,但没有发现磷酸化tau聚集体或淀粉样斑块。本文结果为癫痫和AD的共同机制提供了新的见解,并提示tau可能在两者中发挥重要的病理作用。
方法示意图

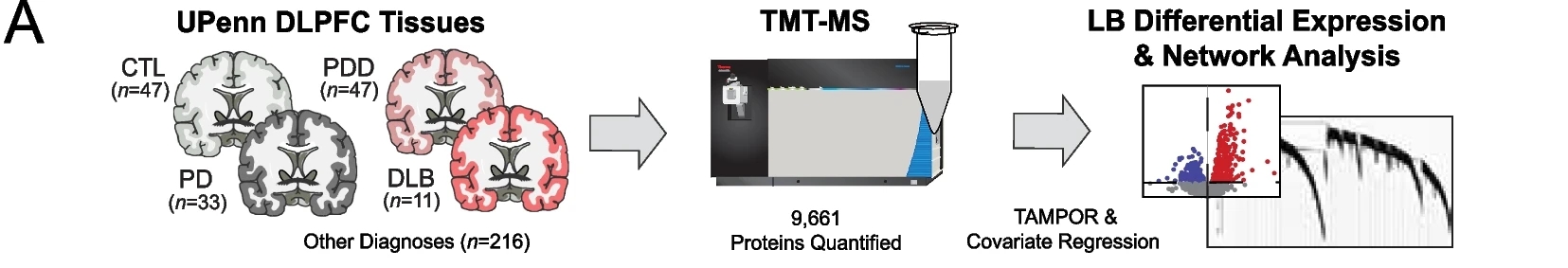
2024年8月6日,埃默里大学的研究团队在 Molecular Neurodegeneration 发文,揭示了路易体痴呆(LBD)与阿尔茨海默症(AD)在病理生理学上的显著差异。
文章通过分析138例大脑背外侧前额叶皮质(DLPFC)的蛋白质组数据,发现LBD中突触相关蛋白模块显著增加,与AD中的突触蛋白减少形成对比。研究还验证了LBD中特定蛋白质模块的变化,并发现这些标志物能够区分LBD中伴随高低β-淀粉样蛋白沉积的病例。研究为LBD的生物标志物开发和临床诊断提供了新的见解。
04
翻译后修饰与疾病机制
糖基化是蛋白质翻译后修饰中至关重要的一环,对调节蛋白质功能和维持大脑健康起着关键作用。近年来,越来越多的研究表明,蛋白质糖基化异常与AD的病理进展密切相关。
下面这篇研究通过完整糖肽的分析,揭示了AD中特异性的糖蛋白修饰模式,为理解该病的分子机制提供了新的视角,并为开发基于糖基化的治疗和生物标志物奠定了基础。
案例1
Sci Adv|基于完整糖肽的阿尔茨海默症糖蛋白组学分析

尽管蛋白质糖基化对大脑健康至关重要,但研究人员对其在阿尔茨海默症(AD)中的具体变化了解有限。2024年4月5日,埃默里大学医学院的 Lian Li 团队在 Science Advances 发表了利用定量糖蛋白质组学和系统生物学方法对人类AD和对照组大脑中的糖基化模式进行全面分析的研究。
研究鉴定了来自近1200种糖蛋白的10,000多种N-糖基化形式,并揭示了AD中唾液酸化减少、N-糖分支和延长减少、以及甘露糖化和N-糖截短增加等显著变化。这些糖基化模式与AD的临床表型、β淀粉样蛋白累积和Tau病理密切相关,提供了疾病发病机制的新见解,并为开发基于糖基化的AD治疗和生物标志物奠定了基础。
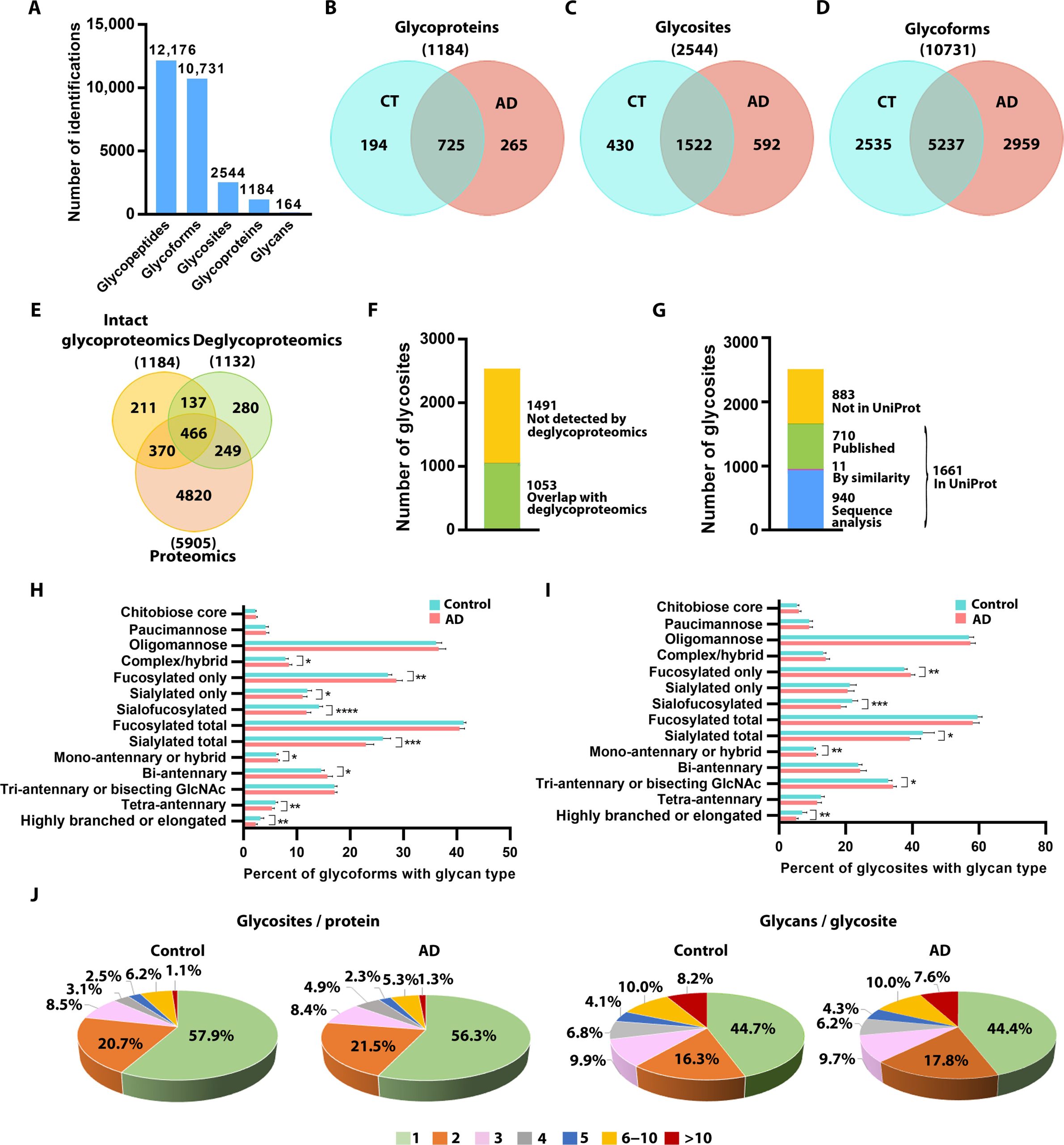
基于完整糖肽的人类 AD 和对照组大脑的糖蛋白质组学分析
他山之石,可以攻玉。上述研究不仅深化了我们对AD的理解,还为未来的研究和临床应用指明了方向。
尽管目前我们仍面临许多挑战,但蛋白质组学的快速发展无疑为AD的早期诊断、精准治疗以及疾病机制的探索提供了强有力的支持。
作为蛋白质组学领域的前沿企业,西湖欧米致力于通过先进的蛋白质组学技术和数据分析方法,为研究人员和临床医生提供深入的洞见。
未来的研究将继续推动我们在阿尔茨海默症领域的知识进步,并帮助我们更好地应对这一全球性的健康挑战。








