文献目录
1 (Nat Med)中英芬三国队列:血浆蛋白质组预测死亡率和疾病风险
2 (Nature)血液检测很快就能预测罹患阿尔茨海默症的风险
3 (Science)偏头痛机制:脑脊液溶质激活三叉神经节
4 (Nat Methods)AI赋能蛋白质组学:从列表到功能解读
5 (Nucleic Acids Res)前列腺癌细胞中染色质相互作用和雄激素受体转录输出
6 (Adv Sci (Weinh))PISA-REX:揭示蛋白质表达与稳定性的综合工具
7 (Mol Neurodegener)路易体痴呆与阿尔茨海默症的突触蛋白质组学差异研究
8 (Cell Discov)机器学习预测结肠癌患者高低危风险
一起来看看上周的蛋白质组学精选优质文献吧!
1.(Nat Med,IF:58.7)中英芬三国队列:血浆蛋白质组预测死亡率和疾病风险

8月8日,牛津大学纳菲尔德人口健康系研究团队在 Nature Medicine 发文,研究开发了一个基于204种蛋白质的蛋白质组衰老时钟(ProtAge),其预测年龄的模型在UKB、CKB和FinnGen三个独立人群中的R²分别为0.88、0.82和0.87,且该模型的表现优于其他DNA甲基化或蛋白质组衰老时钟。
通过追踪这些群体的随访数据,研究发现蛋白质组衰老与生理功能衰退、易患疾病(如阿尔茨海默症、慢性肾病)的风险增加密切相关。研究进一步简化了模型,得到了一个20种蛋白质的版本(ProtAge20),能实现与原204蛋白质模型几乎相同的预测性能。
2.(Nature,IF:50.5)血液检测很快就能预测罹患阿尔茨海默症的风险
8月7日,Nature 发表了一篇 News Feature,讨论了阿尔茨海默症血液检测的最新进展以及其对疾病早期检测和治疗的潜在影响。
文章指出,近年来,阿尔茨海默症研究取得了重大突破:一方面,新药物能够在早期减缓疾病进展;另一方面,科学家成功开发了廉价且高精度的血液生物标志物检测。这些血检方法可在症状出现前识别出疾病风险,提高临床试验效率,并帮助医生准确诊断和监测疾病进程。这些进展不仅为早期干预和治疗提供了可能,也重新激发了制药行业对阿尔茨海默症研究的投资与兴趣。
3.(Science,IF:44.7)偏头痛机制:脑脊液溶质激活三叉神经节

7月4日,哥本哈根大学 Maiken Nedergaard 团队在 Science 发文,研究了偏头痛(migraine)的病理机制。
研究发现脑脊液中的溶质在皮层扩散性抑制(CSD)后会通过直接流动到三叉神经节来激活其神经元。研究表明,CSD导致脑脊液蛋白质组显著变化,尤其是降钙素基因相关肽(CGRP)的浓度增加,这些变化可能通过三叉神经节激活神经元,从而解释了偏头痛的单侧性及先兆与头痛发作之间的关系。这一发现揭示了一条新的中枢与周围神经系统之间的通信路径,并为治疗偏头痛提供了新的潜在靶点。
4.(Nat Methods,IF: 36.1)AI赋能蛋白质组学:从列表到功能解读
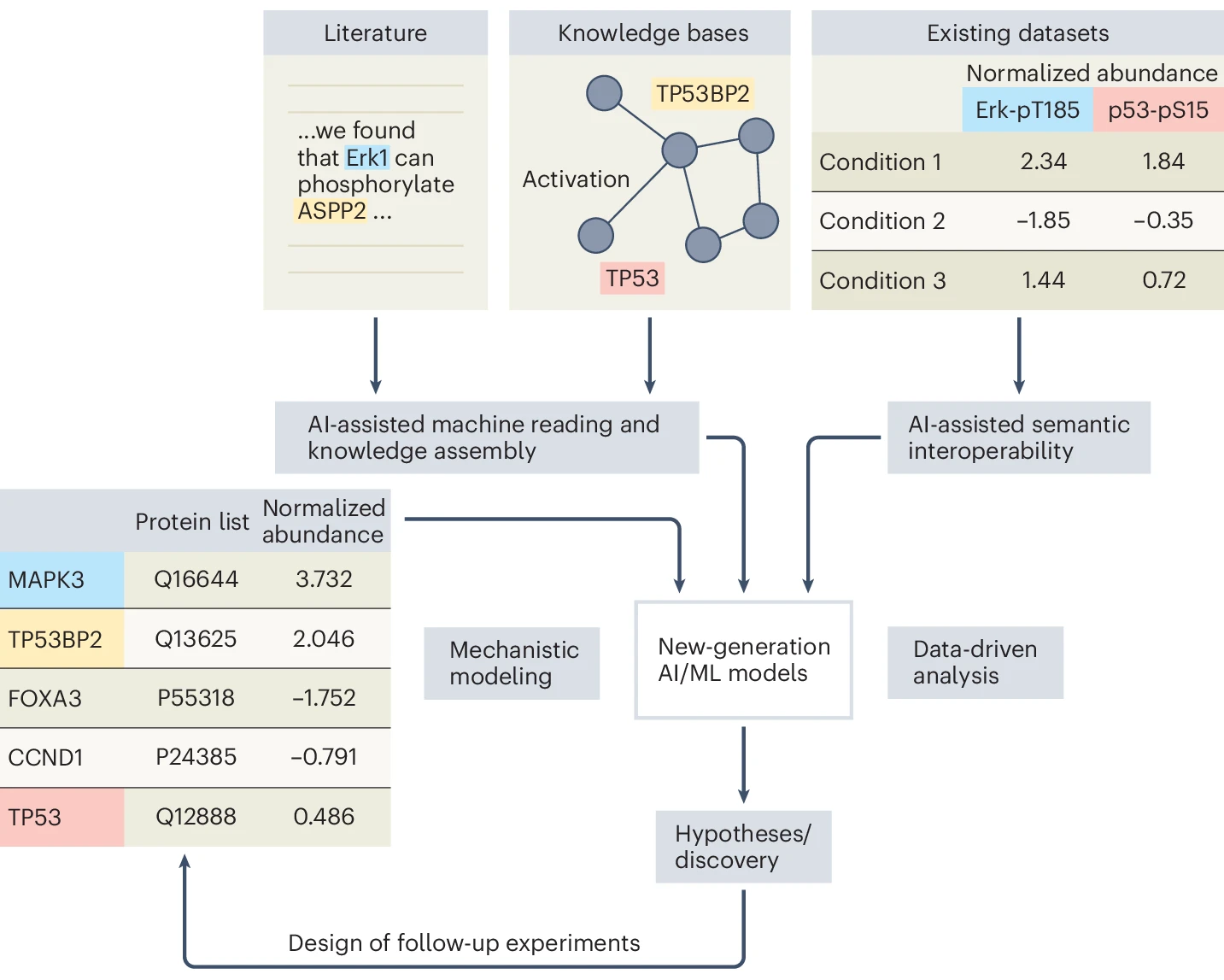
8月9日,东北大学Barnett化学与生物分析研究所的学者在 Nature Methods 发表评论文章。
文章探讨了质谱技术在蛋白质组学研究中的应用现状及其局限性,指出当前研究结果往往以蛋白质列表(protein lists)呈现,缺乏机制性解释。文章展望了人工智能未来在整合生物医学知识、增强数据互操作性、以及改进复杂系统建模方面的潜力,助力蛋白质组学研究实现从数据列表到功能性和机制性解读的转变。
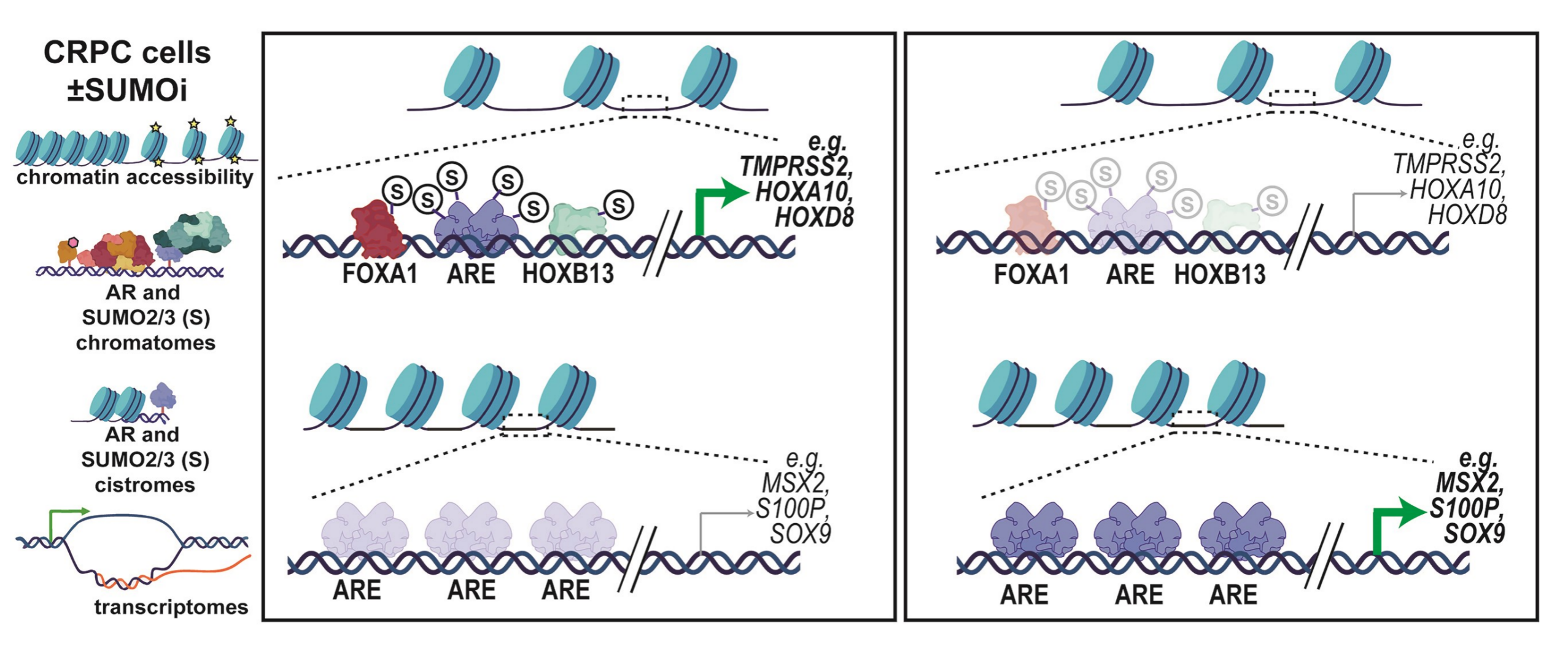
5.(Nucleic Acids Res,IF: 16.6)前列腺癌细胞中染色质相互作用和雄激素受体转录输出

8月6日,东芬兰大学的研究人员在 Nucleic Acids Research 发文,探讨了SUMOylation(一种蛋白质翻译后修饰)在前列腺癌细胞染色质相互作用和雄激素受体(AR)转录输出调控中的核心作用 。
研究使用染色质蛋白质组学(chromatin proteomics)等技术,发现SUMO2/3与AR的染色质蛋白网络显著关联,并通过抑制SUMOylation揭示了它对AR在染色质上的结合及基因表达的调节作用。这些发现强调了SUMOylation在前列腺癌中调控AR功能的关键角色,可能揭示新的治疗策略。
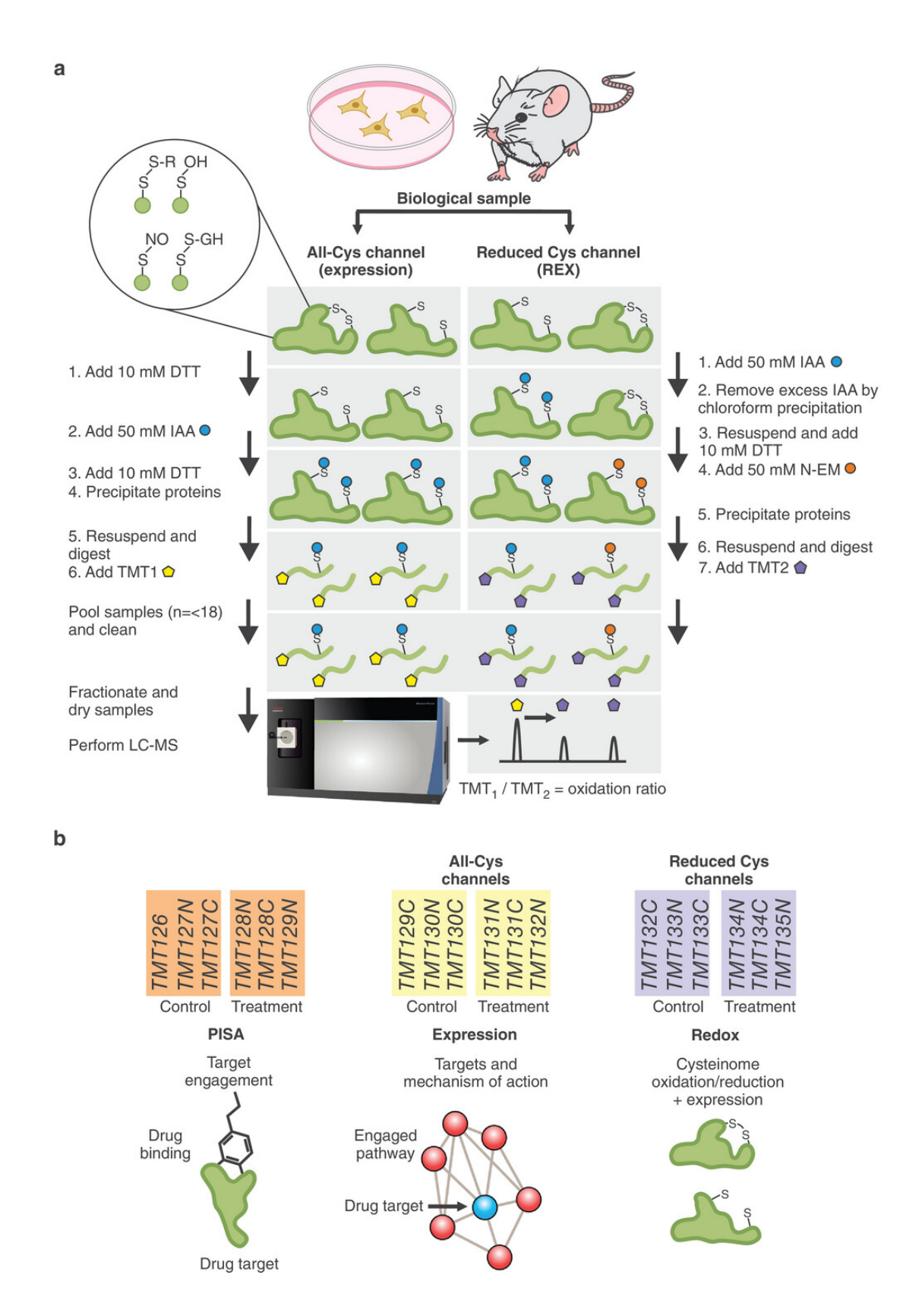
6.(Adv Sci (Weinh),IF: 15.8)PISA-REX:揭示蛋白质表达与稳定性的综合工具

8月9日,瑞典卡罗林斯卡医学院和哈佛医学院的研究团队在 Advanced Science 发文,介绍了一种名为 PISA-REX 的新型高通量蛋白质组学工具。
PISA-REX结合了蛋白质表达、可溶性/稳定性和氧化还原状态的分析,能够在单个实验中进行多维度的蛋白质组研究。研究通过对不同的细胞和模型系统(如HCT116细胞、人单核细胞、小鼠浆细胞样树突状细胞)进行测试,验证了这种方法在药物靶标鉴定和疾病机制研究中的有效性。结果表明,该方法在覆盖率、成本效益和数据一致性方面优于现有的氧化还原蛋白质组学技术,有望成为蛋白质组学行业新标准。
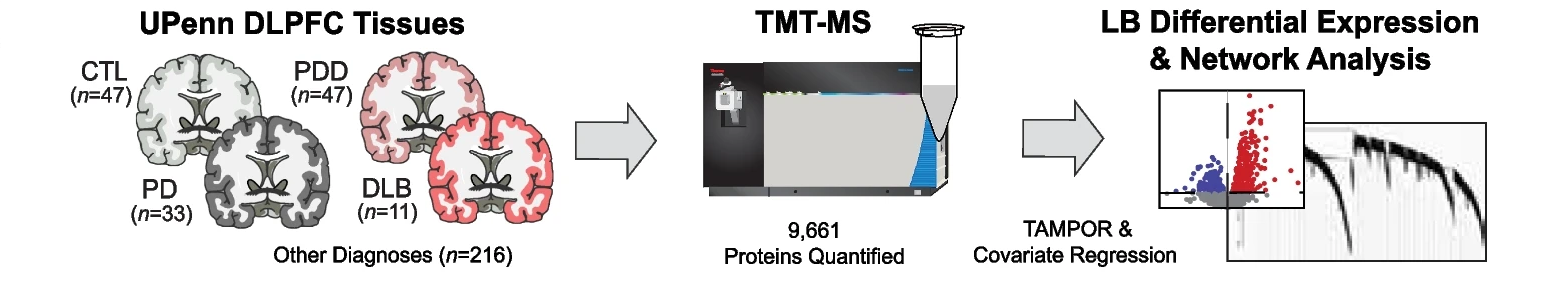
7.(Mol Neurodegener,IF: 14.9)路易体痴呆与阿尔茨海默症的突触蛋白质组学差异研究

8月6日,埃默里大学的研究团队在 Molecular Neurodegeneration 发文,揭示了路易体痴呆(LBD)与阿尔茨海默症(AD)在病理生理学上的显著差异。
文章通过分析138例大脑背外侧前额叶皮质(DLPFC)的蛋白质组数据,发现LBD中突触相关蛋白模块显著增加,与AD中的突触蛋白减少形成对比。研究还验证了LBD中特定蛋白质模块的变化,并发现这些标志物能够区分LBD中伴随高低β-淀粉样蛋白沉积的病例。研究为LBD的生物标志物开发和临床诊断提供了新的见解。
8.(Cell Discov,IF:13)机器学习预测结肠癌患者高低危风险

8月13日,西湖大学医学院郭天南团队,联合浙江大学医学院附属第二医院邵营宽、袁长征,西京医院聂勇战团队,共同在 Cell Discovery 发表通讯文章,开发了一种基于蛋白质组数据的结肠癌患者高低危风险的分类模型。
研究通过收集230例II期和III期结肠癌患者的蛋白质组学和临床数据,使用LASSO回归筛选出9种关键蛋白质,结合临床特征建立了预测结肠癌高低风险的模型。研究结果显示,结合蛋白质组和临床特征的模型在训练集中预测5年生存率的AUC值达到0.926,在外部验证集中为0.872,显著优于单一临床模型或蛋白质模型。该模型有效地将患者分为低风险组(训练集5年生存率95%,验证集93%)和高风险组(训练集39%,验证集53%),为结肠癌患者的个性化治疗提供了重要依据。