文献目录
1 (Nat Med) 蛋白组学揭示「社会弱势」如何加速衰老并增加疾病风险
2 (Cell) 微生物组研究的临床转化挑战与迭代研究策略
3 (Nat Genet) PD-L1琥珀酰化调控及其在黑色素瘤免疫治疗中的作用
4 (Adv Sci (Weinh)) 高通量蛋白异构体成像揭示AD相关脑组织分子变化
5 (Nat Comm) MEDUSA Search:高分辨质谱数据解析与有机反应发现
6 (Nat Comm) Orbitrap Astral 提升血浆N-糖蛋白组学检测深度与通量
7 (Nat Comm) 基于皮肤类器官的EV-A71感染研究及潜在抑制剂筛选
8 (Cell Discov) 基于稀疏采样和深度学习的高通量空间蛋白质组学研究
一起来看看本期的蛋白质组学精选优质文献吧!
1. (Nat Med,IF:58.7)蛋白组学揭示「社会弱势」如何加速衰老并增加疾病风险

3月14日,伦敦大学学院(UCL)脑科学学院的研究团队在 Nature Medicine 发表了一篇重要的研究论文,系统探讨了社会弱势如何加速生物衰老并增加衰老相关疾病(ARDs)的风险。
基于多个大规模队列,研究发现社会弱势个体(如低教育水平、低社会经济地位)患66种衰老相关疾病的风险显著增加,尤其是在免疫、代谢、循环和神经退行性疾病中表现突出。这一关联部分由14种衰老相关蛋白介导,其中NF-κB/IL-8炎症通路在该过程中起关键作用。
此外,研究发现社会地位的改善可降低不利蛋白表达,而社会弱势的累积与蛋白水平和疾病风险之间存在剂量-反应关系。独立队列验证了这些发现,并排除了健康相关选择和遗传因素的主要影响,进一步支持了社会因果假设,即社会弱势通过生物学机制加速衰老。
研究强调了社会不平等在健康老龄化中的核心作用,并为未来的健康干预提供了潜在的生物学靶点。
2.(Cell,IF:45.5)微生物组研究的临床转化挑战与迭代研究策略

3月6日,以色列巴伊兰大学的研究人员在 Cell 发表了一篇前瞻性文章(Perspective),探讨了微生物组研究向临床转化的挑战,并提出一种迭代研究策略(Iterative strategy),结合大数据分析(多组学方法,包括宏基因组学、宏转录组学、宏蛋白质组学和代谢组学)与实验模型(体外、动物实验),推动因果机制的验证和微生物组疗法的开发。
文章强调从相关性研究向因果研究的转变,并回顾了人工微生物组疗法(如微生物联合体、噬菌体、精准益生菌等)在临床前和临床研究中的进展,同时指出动物模型的局限性及个性化治疗需求。
最终,文章强调通过整合传统微生物学与现代数据驱动方法,可加速微生物组疗法向临床应用的转化,为多种疾病提供新型治疗方案。

3.(Nat Genet,IF:31.7)PD-L1琥珀酰化调控及其在黑色素瘤免疫治疗中的作用

3月11日,中南大学湘雅医院皮肤科及中南大学生命科学学院的研究团队在 Nature Genetics 发文,通过空间转录组学、bulk RNA-seq和蛋白质组学分析,揭示了琥珀酰化(succinylation)在PD-L1稳定性及抗肿瘤免疫中的关键作用。
研究发现,琥珀酰辅酶A(succinyl-CoA)水平升高可促进PD-L1在Lys129位点的琥珀酰化,导致其通过内体-溶酶体通路降解,从而增强CD8+ T 的抗肿瘤活性。此外,CPT1A被鉴定为PD-L1的琥珀酰转移酶,其表达水平与抗PD-1疗效相关。
进一步研究显示,降脂药Bezafibrate(BEZ)可上调CPT1A,协同抗CTLA-4单抗抑制肿瘤生长,提出了一种新的免疫治疗策略。
本研究表明,PD-L1琥珀酰化及CPT1A可作为免疫治疗的潜在生物标志物和治疗靶点,为优化黑色素瘤免疫治疗提供了新思路。
4.(Adv Sci (Weinh),IF:15.8)高通量蛋白异构体成像揭示AD相关脑组织分子变化

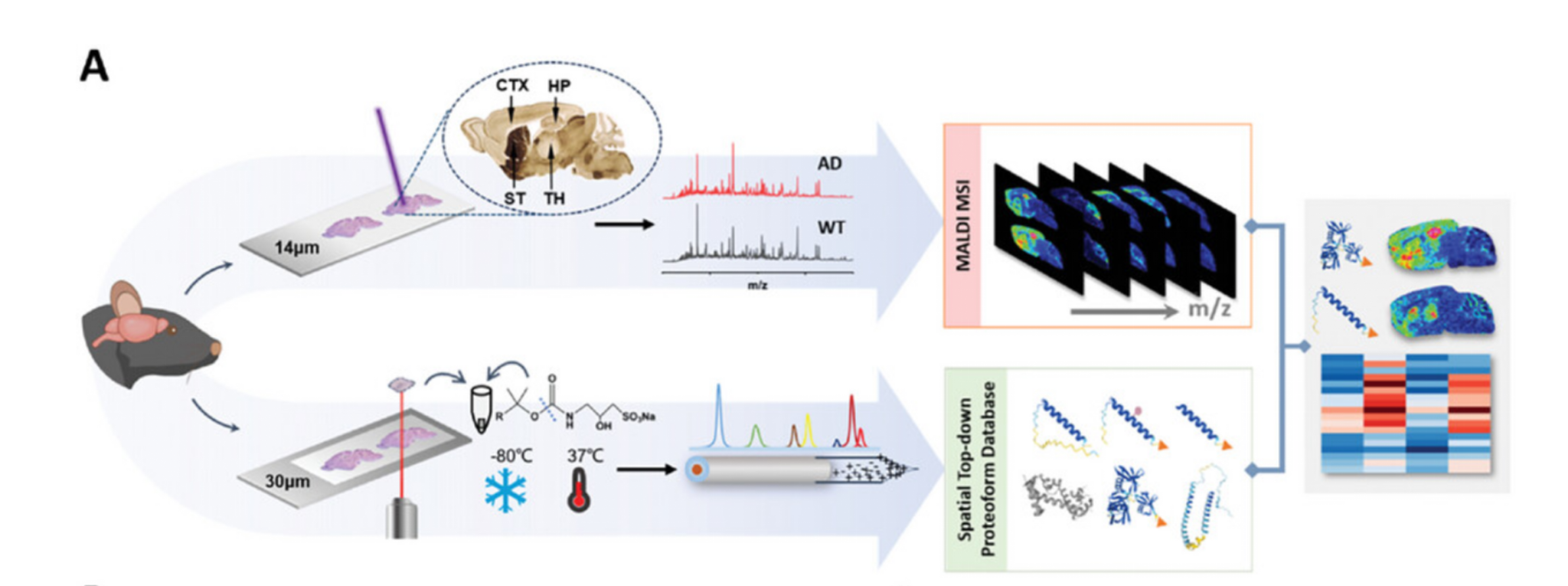
3月12日,中国科学院大连化学物理研究所张丽华团队在 Advanced Science 发文,研究建立了一种高通量蛋白异构体成像(HTPi)方法,结合MALDI MSI与区域特异性Top-down蛋白质组学,实现对组织切片中蛋白异构体的高分辨率成像和精准鉴定。
该方法成功揭示了小鼠大脑不同区域蛋白异构体的空间分布模式,并在阿尔茨海默症(AD)模型中发现14种与Aβ病理显著相关的差异蛋白异构体。
HTPi为研究脑组织的分子异质性和疾病机制提供了强有力的工具,并在生物标志物发现、疾病诊断等临床应用方面具有重要潜力。
5.(Nat Comm,IF:14.7)MEDUSA Search:高分辨质谱数据解析与有机反应发现

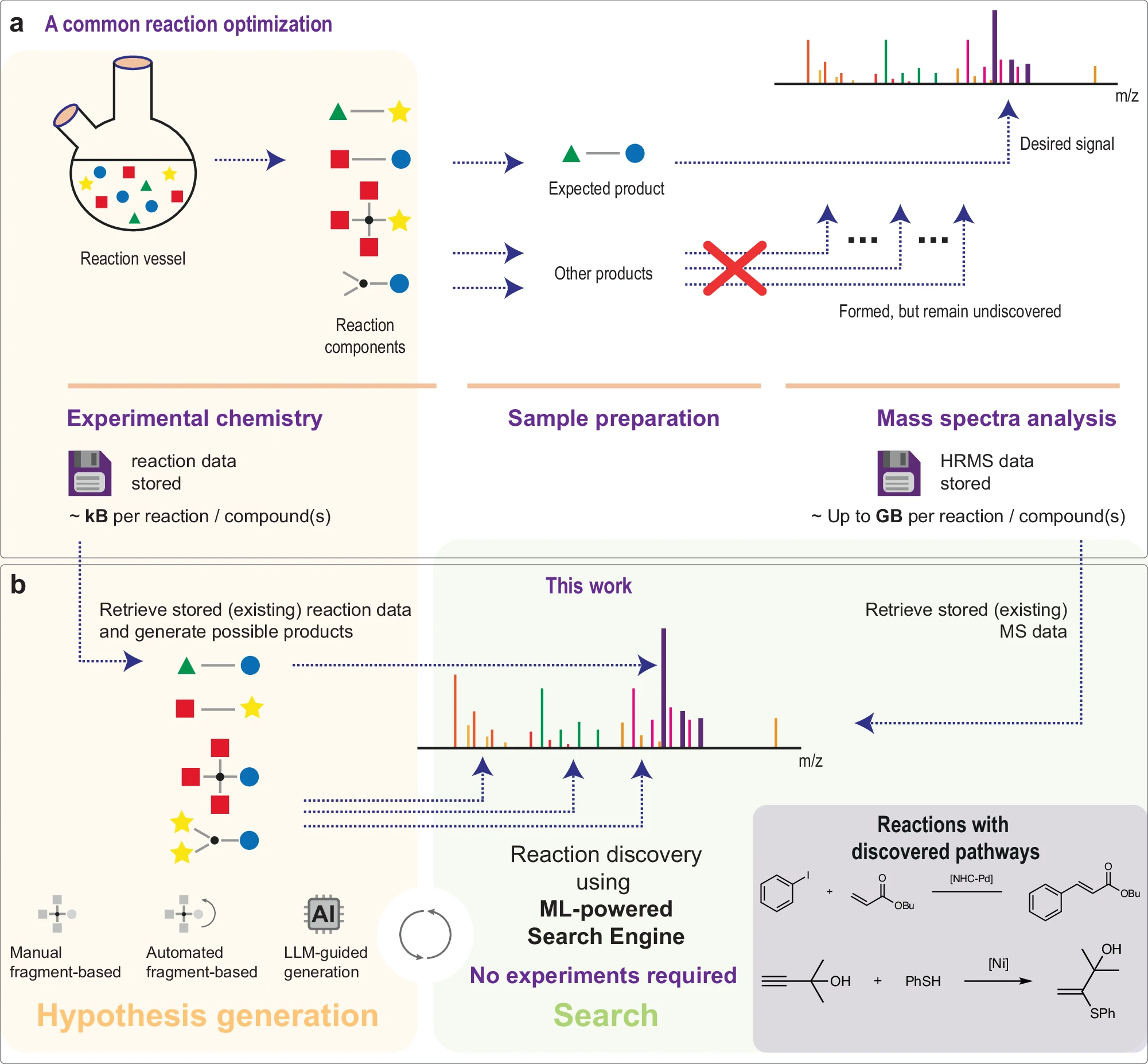
3月16日,俄罗斯科学院有机化学研究所的研究团队在 Nature Communications 发文,提出了一种基于机器学习(ML)的搜索引擎MEDUSA Search,用于分析超大规模(Tera-scale)高分辨质谱(HRMS)数据,以发现新化学反应。
MEDUSA Search结合同位素分布搜索算法和ML模型,实现了对存量实验数据的自动筛选与解析,从而降低实验需求,推动化学数据的再利用。研究借鉴了蛋白质组学和代谢组学等领域对HRMS数据的利用方式,成功发现多个新反应,包括Mizoroki-Heck反应中的heterocycle-vinyl coupling 过程,并通过实验验证了其可行性。
这一研究为数据驱动的有机化学发现提供了新范式,助力绿色可持续化学的发展。
6.(Nat Comm,IF:14.7)Orbitrap Astral提升血浆N-糖蛋白组学检测深度与通量

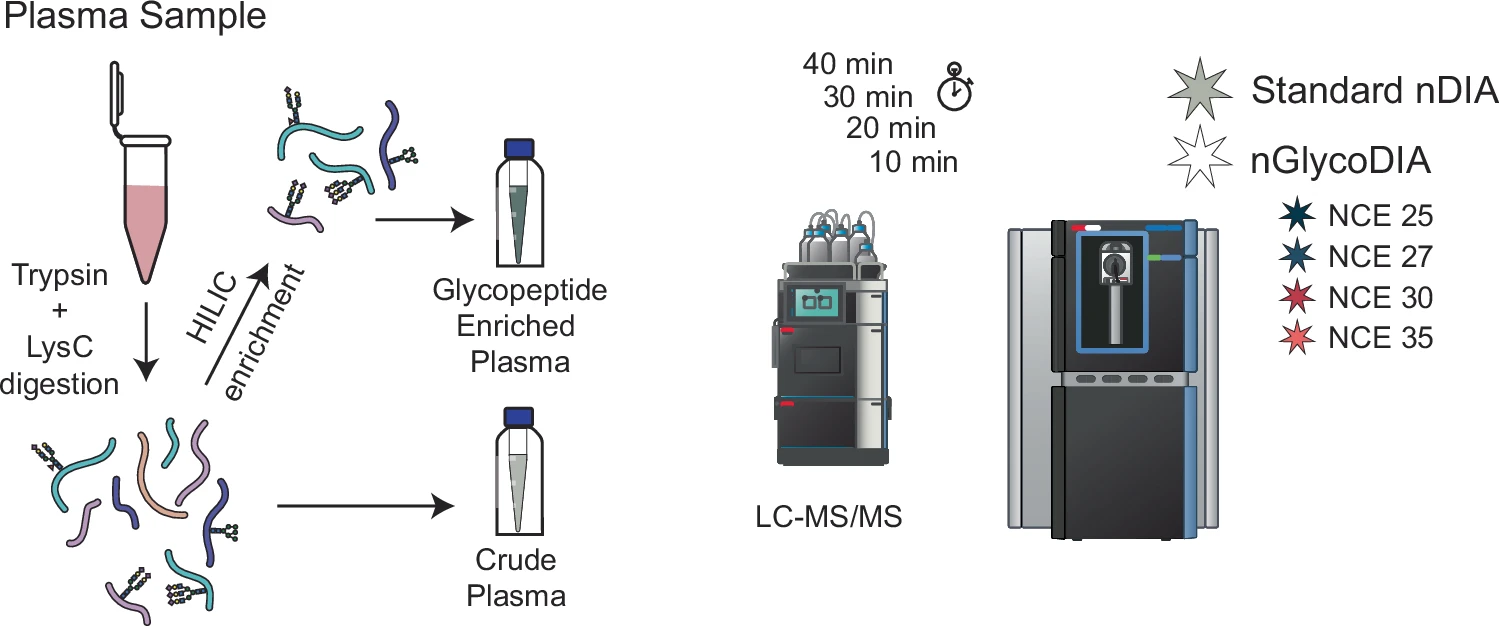
3月13日,荷兰乌得勒支大学的研究团队在 Nature Communications 发文,评估了Orbitrap Astral质谱仪在血浆N-糖蛋白组分析中的性能,并开发了窄窗口数据非依赖性采集(nGlycoDIA) 方法。
通过优化糖肽富集、LC梯度和碰撞能量,该方法 在40 min内鉴定出3000+糖肽,覆盖181种糖蛋白,较DDA方法提高 50%。此外,nGlycoDIA可检测低丰度糖基化蛋白(如细胞因子),并在10 min内完成高通量分析,为临床糖蛋白组学、疾病标志物筛选和精准医学提供了新的技术手段。
7.(Nat Comm,IF:14.7)基于皮肤类器官的EV-A71感染研究及潜在抑制剂筛选

3月13日,北京协和医学院和国家蛋白质科学中心(北京)的研究团队在 Nature Communications 发表研究,利用人诱导多能干细胞(hiPSC)衍生的皮肤类器官(hiPSC-SOs)作为EV-A71病毒感染模型,并结合蛋白质组学和单细胞RNA测序(scRNA-seq)分析病毒对不同皮肤细胞类型的影响。
研究发现EV-A71感染可导致细胞外基质(ECM)降解,特别是胶原蛋白代谢(COL1A1、COL1A2、COL3A1等)和弹性蛋白相关蛋白(LOX、EMILIN1)的下调,从而影响皮肤完整性并加速皮肤衰老。
此外,研究发现EV-A71通过Integrin/Hippo-YAP/TAZ信号通路激活表皮祖细胞的异常增殖,可能与肿瘤发生相关。基于蛋白质组学数据,研究团队确定HMGB1为病毒复制的重要调控因子,并筛选出其抑制剂NSC 167409,该药物可有效抑制病毒复制、减少炎症,并抑制异常细胞增殖,展现出良好的临床应用前景。
研究不仅揭示了EV-A71感染的关键分子机制,也证明了皮肤类器官作为感染模型的价值,为EV-A71的治疗提供了新的策略。
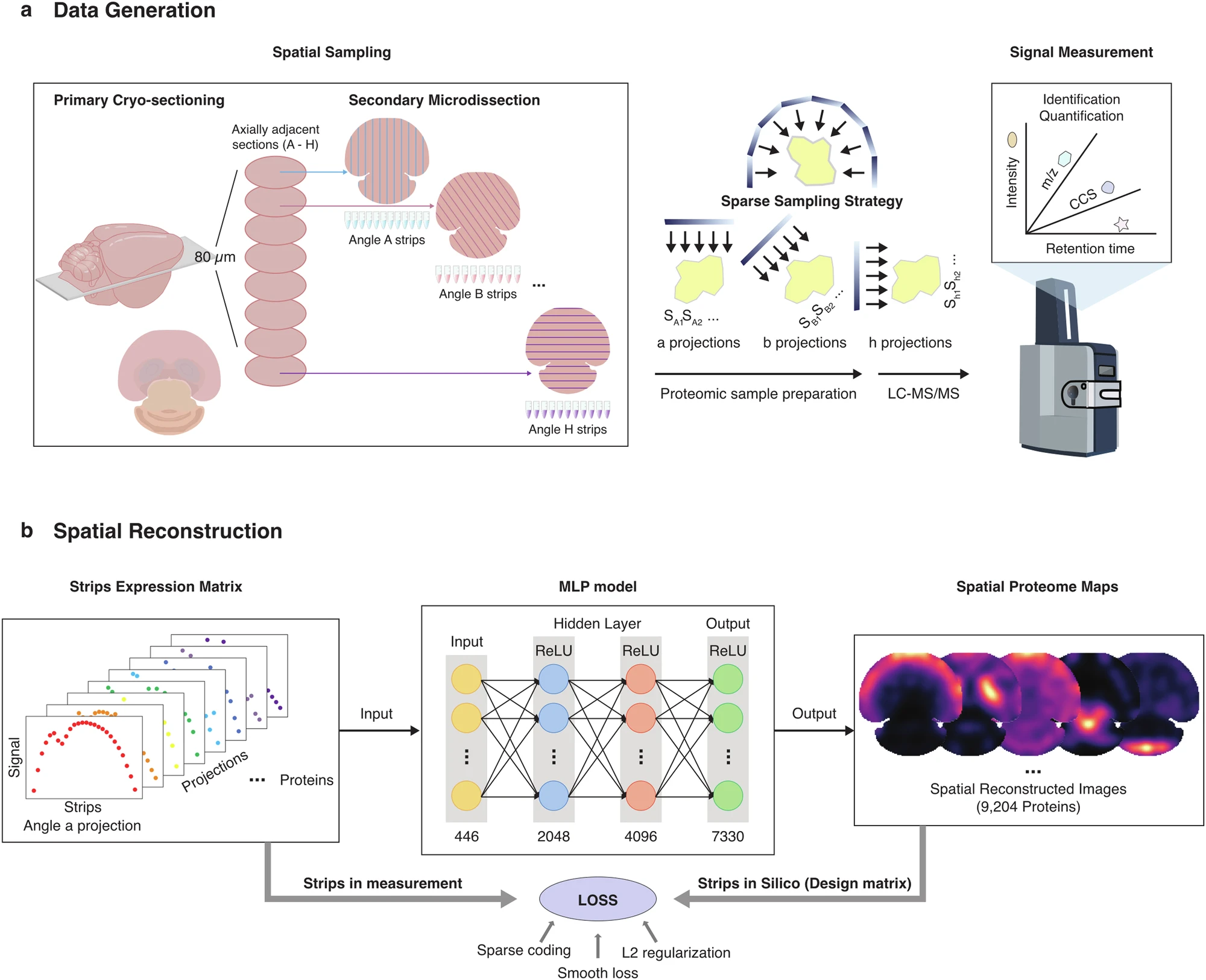
8.(Cell Discov,IF: 13)基于稀疏采样和深度学习的高通量空间蛋白质组学研究

3月11日,国家蛋白质科学中心(北京)的研究团队在 Cell Discovery 发表研究,提出了一种基于稀疏采样和深度学习的空间蛋白质组学方法(S4P),以高效、高分辨率地绘制全组织切片的蛋白质分布图谱。
S4P通过多角度微解剖和计算机重建,大幅减少质谱检测时间,同时显著提升蛋白质覆盖度,成功绘制了迄今为止最大规模的空间蛋白质组(覆盖9204种蛋白质),并揭示了 RNA 与蛋白质在空间分布上的不一致性。
该方法在神经科学、疾病研究及精准医学等领域具有广泛应用前景,为理解组织异质性和疾病机制提供了新的技术工具。