研究背景及简介
肝癌是导致全球癌症死亡的最主要原因之一,根据2020年中国统计的癌症数据,肝癌的死亡率排名第二。原发性肝癌包含三种类型:肝细胞癌(Hepatocellular carcinoma,HCC)、肝内胆管癌(Intrahepatic cholangiocarcinoma,CCA)和混合型肝细胞癌-胆管癌(Mixed cell carcinoma,MCA)。
原发肝细胞癌是最常见的肝恶性肿瘤,占80%以上。CCA是第二常见的原发性肝恶性肿瘤,大约占10-15%。HCC与CCA之间存在显著差异,首先,乙肝病毒和丙肝病毒感染是HCC的重要危险因素,而肝内胆管结石是CCA的独立危险因素。其次,与HCC相比,CCA中有显著的异质性,HCC是在慢性肝病的背景下发生的,而大多数CCA是在正常的肝脏中发生的,没有任何明显的危险因素。此外,它们在治疗和预后方面存在差异。
CCA比HCC更具侵袭性,当进行根治性肝切除术时,CCA的切除范围比HCC更广泛。最近的一项临床研究表明CCA患者相较HCC而言有更短的生存期,另一项通过整合基因组学、转录组学和代谢组学数据,确定了CCA和HCC患者两种常见的分子亚型,一个由PLK1和ECT2驱动,另一个由肥胖、T细胞浸润和胆汁酸代谢驱动。尽管有这些发现,但HCC和CCA的发病机制和分子水平的变化仍未被完全了解。
2023年6月,来自西湖大学的朱怡博士及合作者在 Molecular & Cellular Proteomics 发表了名为 Proteome Landscapes of Human Hepatocellular Carcinoma and Intrahepatic Cholangiocarcinoma 的研究。
该研究对107名肝癌患者的163个肝组织样本进行了基于DIA的蛋白质组学分析。通过比较HCC和CCA的定量蛋白质组数据,揭示了不同的蛋白分子特征。

研究样本
(1)队列1:56名肝癌患者的肿瘤组织及邻近良性组织,包含41名HCC患者、12名CCA患者及3名MCA患者;
队列2:34名HCC患者,17名CCA患者
(2)组学方法:DIA蛋白组

研究结果
1.HCC和CCA不同的蛋白质组景观和特征
通过定量蛋白组共鉴定并定量到104,489个多肽和8057个蛋白。为了确定每种肝癌中特异表达的蛋白,作者对肿瘤组织和邻近良性组织进行了差异分析,其中MCA患者没有发现任何显著变化的蛋白,因此在后续的分析中,重点关注了HCC和CCA。
在HCC患者中,有3,378个蛋白的表达明显失调,其中87%的蛋白在肿瘤组织中表达上调(图1A),通过IPA分析发现绝大部分通路被激活,这些激活的通路主要参与到转录、mRNA翻译调控和翻译后修饰中,比如EIF2 signaling、he regulation of eIF4E and p70S6K signaling、the spliceosomal cycle、sirtuin signaling、mTOR signaling、tRNA charging等(图1B)。
在CCA中,共得到820个差异蛋白,与HCC不同的是,97%的蛋白在肿瘤组织中表达下调(图1C),通过IPA分析发现通路大多被抑制,这些途径主要与肝脏代谢过程有关,如oxidative phosphorylation、fatty acid β-oxidation I、serotonin degradation等(图1D)。
接下来,作者对HCC 组和 CCA 组的差异表达蛋白进行了比较,发现在这两个组中有296个下调蛋白质和17个上调蛋白质重叠(图1E)
作者使用Metascape对这些蛋白进行了通路富集分析,下调蛋白主要参与了与小分子代谢过程相关的通路(图1F),上调蛋白参与了系统进展、超分子纤维组织和蛋白复合物寡聚化等过程(图1G)。为了研究 HCC 和 CCA 之间的差异,对 HCC 和 CCA 肿瘤组织蛋白表达进行了GSEA分析发现在CCA肿瘤组织中,细胞外基质(ECM)相关通路被显著激活,包括 secreted factors、MET activates PTK2 signaling、laminin interactions 等。
由于 ECM 相关蛋白表达的上调与肿瘤转移和侵袭有关,这一发现可能解释了 CCA 的高度恶性、易累及外周器官以及发生远处转移的特点。
HCC肿瘤组织脂质代谢相关通路显著富集,如血浆脂蛋白形成、脂质代谢,SREBP信号、维生素和脂溶性代谢、维生素代谢、类固醇代谢等(图1H),值得注意的是,脂质代谢重编程可以为HCC细胞提供能量。
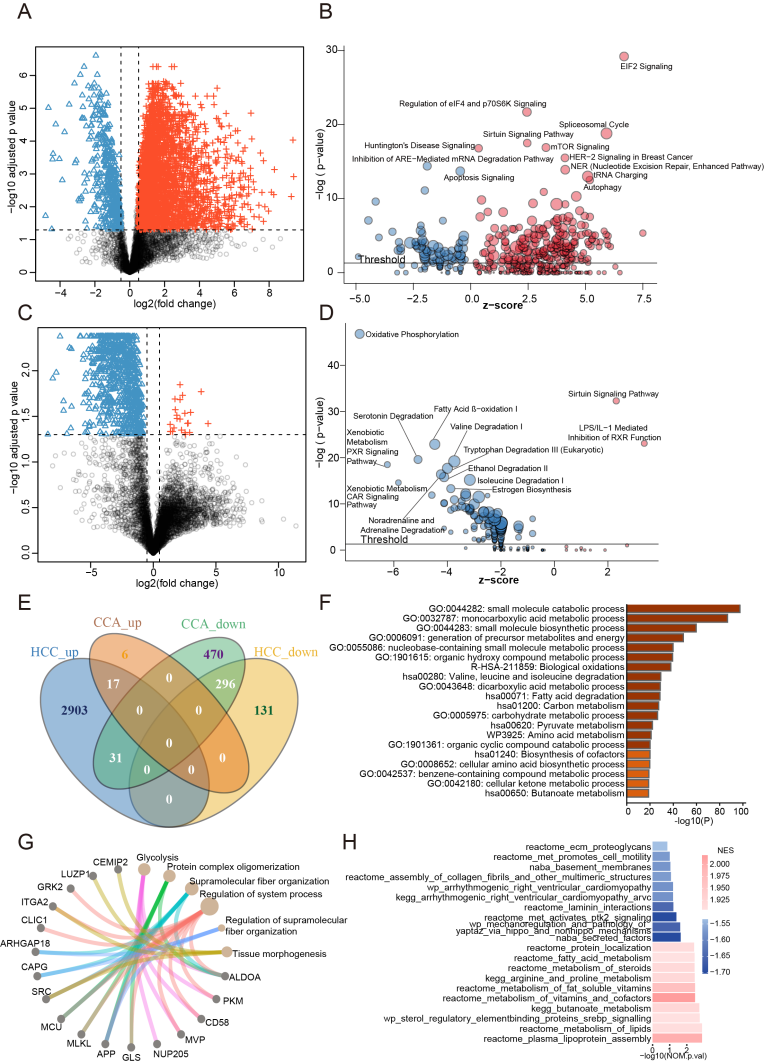
图1 HCC和CCA患者不同的蛋白质组景观和特征
2. 区分HCC、CCA和良性组织的关键蛋白
为了将组织样本区分为属于HCC、CCA或良性组织,作者基于随机森林的特征选择鉴定出73个关键蛋白。
基于73个蛋白对HCC、CCA和良性组织进行无监督聚类分析,发现大多数样本可以根据其病理类型进行聚类,表明这些蛋白可以用来区分三种组织类型(图2A)。
另外,每个簇的蛋白富集在特定的生物过程中:小分子代谢过程、脂质代谢过程和基底膜组装(图2A,2B)。
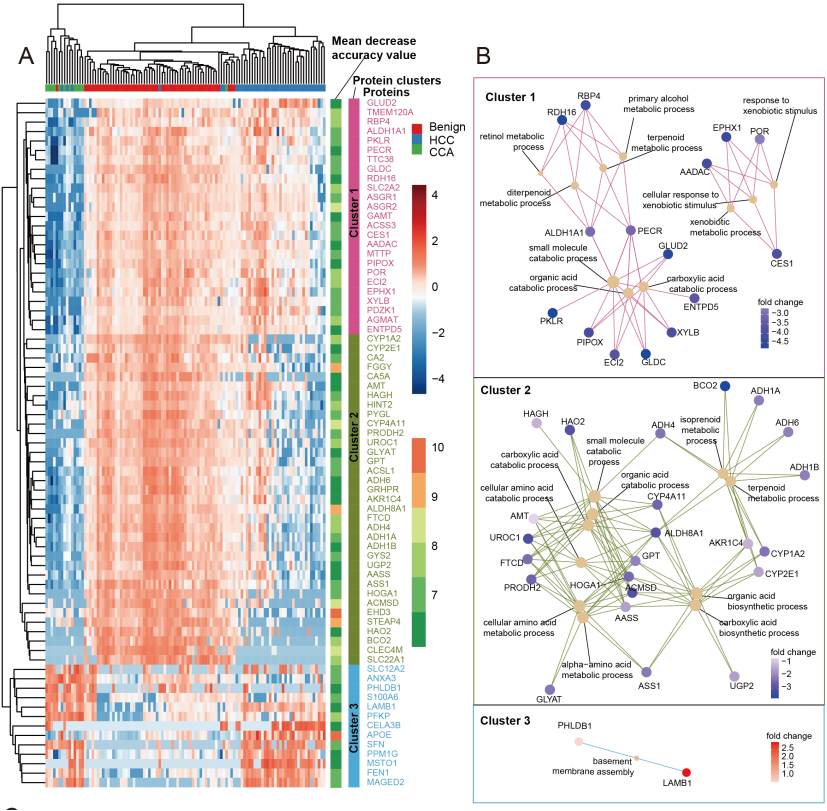
图2 基于机器学习区分HCC、CCA和良性组织
3. 基于机器学习的HCC和CCA肿瘤组织分类
作者开发了一个机器学习分类模型来区分HCC和CCA肿瘤(图3A)。训练集包含了41例HCC患者和12例CCA患者,使用随机森林进行特征选择,按准确性排名筛选了前15个蛋白质(图3B),训练队列进一步分为内部训练集(80%)和验证集(20%),值得注意的是,一个三蛋白的panel(APOE、PKLR和GALK1)表现出优异的性能,基于这三个蛋白训练出最终模型。
该三蛋白分类模型在训练队列中的AUC为0.98,准确率为1,敏感性、特异性、阳性预测值(PPV),阴性预测值(NPV)分别为0.83、1、1和0.95(图3A、3C、3D和3G)。
最后,作者使用一个独立的验证队列来评估模型的性能,包括34例HCC患者和17例CCA患者,验证集AUC值为0.92,验证队列中51个样本中有46个被正确分类,敏感性、特异性、PPV和NPV分别为0.89、0.94、0.89和0.94(图3A、3F和3G)。
该模型中的三种蛋白在训练集和验证集中有相同的表达模式,值得注意的是,APOE和PKLR也在区分HCC、CCA和良性组织的73个关键蛋白中之中。

图3 基于机器学习的HCC和CCA肿瘤组织分类
文章小结
在这项工作中,作者探索了两种原发性肝癌HCC和CCA不同的蛋白质组景观,HCC患者出现脂质代谢异常,相关蛋白表达上调,包括ACACB、SCD、PCCA、PCCB、AKR1C4、MMUT等,CCA患者细胞外基质相关通路显著激活。
基于蛋白组的数据,该研究团队训练了一种机器学习模型,APOE、PKLR和GALK1蛋白可以成功地区分HCC和CCA。本研究中提出的HCC和CCA独特的分子特征为这两种主要的原发性肝癌提供了新的见解,有助于开发更有效的诊断方案和新的靶向药物治疗。
论文链接:
https://www.mcponline.org/article/S1535-9476(23)00115-9/fulltext