2022年3月,爱丁堡大学的 Lucija Klarić 等人在Nature Communications 上发表了一篇文章: Genetic regulation of post-translational modification of two distinct proteins,主要围绕着两种不同蛋白质的糖基化后翻译修饰(PTM)的遗传调控展开研究(铁蛋白和免疫球蛋白G(IgG))。

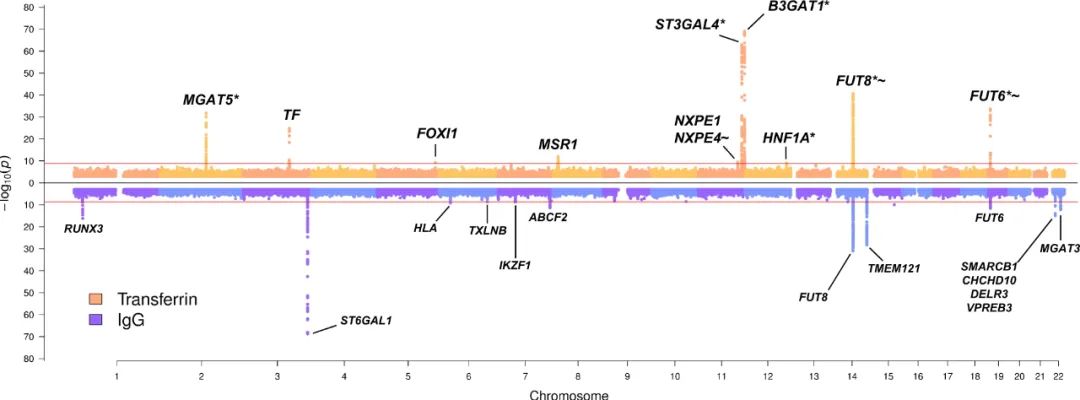
转铁蛋白和 IgG N-糖组 GWAMA 迈阿密图(Miami )概要
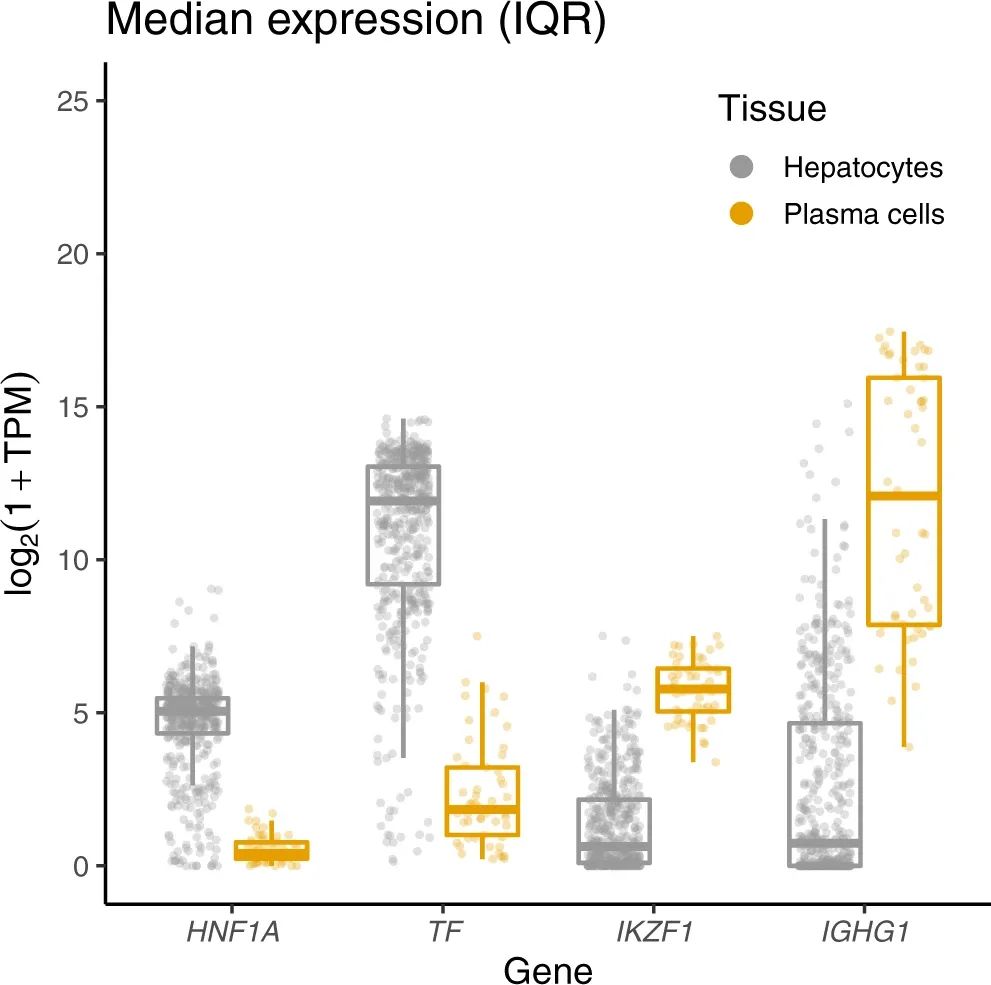
转铁蛋白和IgG合成的主要组织(肝脏和浆细胞)中TF、IGHG1、HNF1A和IKZF1的表达
在结果和讨论部分,论文首先介绍了对转铁蛋白N-糖基化进行的全基因组关联分析(GWAS)。研究人员发现了一些与转铁蛋白N-糖基化相关的显著位点,这些位点涉及到编码参与N-糖基化通路酶的基因,以及转铁蛋白基因本身。
另一个重要的分析是共定位分析,用于评估引发性遗传变异是否特定于某种蛋白质或者在转铁蛋白和免疫球蛋白G(IgG)的N-糖基化之间共享。结果表明,不同基因调控着转铁蛋白和免疫球蛋白G(IgG)的糖基化修饰,这揭示了蛋白质特异性的遗传调控机制。
另外,论文还介绍了一些有趣的发现,如一些遗传关联不仅与糖基化修饰有关,还与某些复杂性状或疾病存在关联,这为疾病的研究提供了新的视角。
最后,研究强调了转铁蛋白和免疫球蛋白G(IgG)糖基化存在着蛋白质特异性和共享的遗传关联。尽管这两种蛋白质的糖基化涉及相同的酶(FUT8和FUT6),但其调控受到独立的、蛋白质特异性的遗传变异的影响。此外,组织特异性的转录因子可能在这些糖基化修饰的遗传调控中扮演重要角色。
总之,这项研究的结果揭示了糖基化修饰在两种蛋白质中的遗传调控方式存在相似之处,也存在差异。通过研究转铁蛋白和IgG的糖基化,研究人员揭示了这些修饰的遗传调控机制,为进一步探索糖基化与复杂性状和疾病之间的关系提供了重要的见解。
论文链接:
https://www.nature.com/articles/s41467-022-29189-5









