甲谱诺ThyroProt™是基于液相色谱-串联质谱(LC-MS/MS)技术和荧光PCR技术,对甲状腺结节细针穿刺活检样本中14种与甲状腺/肿瘤发生发展相关的蛋白定量及可能的BRAFV600E突变进行检测。以上各项检测结果结合患者临床特征,使用包含人工智能算法技术的甲状腺结节良恶性分析软件分析并计算综合评分,对样本呈现的甲状腺结节良恶性风险进行判断。

♦ 甲状腺结节及良恶性诊断现状
甲状腺结节是常见病,在中国成人中通过超声检查发现直径0.5cm以上甲状腺结节的患病率达到20.43%,其中8%-16%为恶性肿瘤[1]。近年来,我国甲状腺癌发病率显著增加,尽管甲状腺癌整体恶性程度较低,但是仍然威胁患者的生命健康及生活质量。临床工作的重点是如何将甲状腺癌从高发的甲状腺结节中甄别出来,从而选择合理的治疗策略。
高分辨率超声是评估甲状腺结节最重要的影像学检查手段,对所有已知或怀疑的甲状腺结节均首选行超声检查[1]。通过颈部超声检查,可确定结节大小、数量、位置、囊实性、形状、边界、钙化、血供及周围组织的关系。同时评估颈部有无异常淋巴结及其部位、大小、形态、血流和结构特点等。
甲状腺影像报告和数据系统(TI-RADS)对甲状腺结节恶性程度进行评估,有助于规范甲状腺超声报告。中国版甲状腺影像报告与数据系统(C-TIRADS)简单易行,较适用于中国人群(表1)。其中超声检查难以明确良恶性结节,可借助超声引导下细针抽吸活检(FNAB)获取细胞成分,通过细胞学诊断病灶性质。
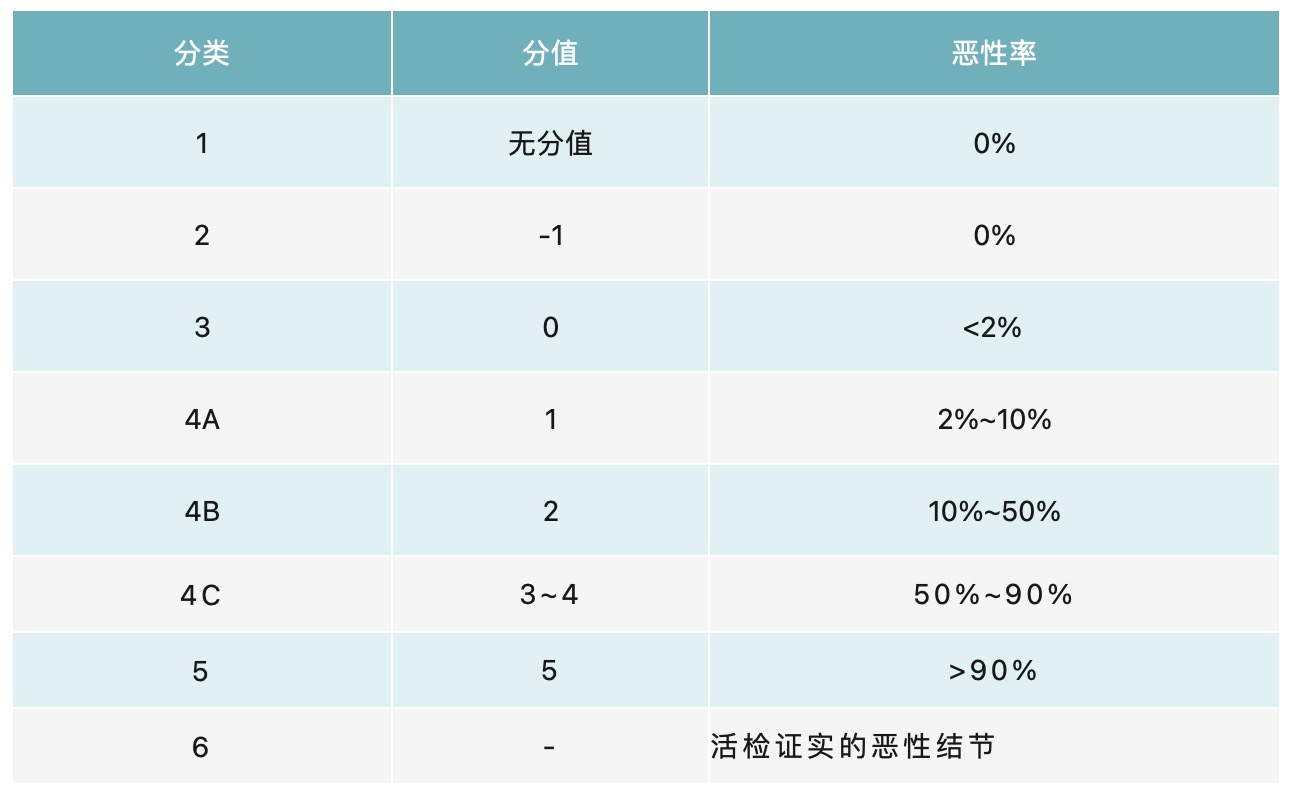
表1 超声评估甲状腺结节的TI-RADS分类[1]
FNAB是通过细针抽吸获取甲状腺结节的病变细胞进行病理学诊断,准确、经济、有效,是甲状腺结节术前首选的病理诊断方法[1]。超声引导甲状腺结节FNAB的适应证(符合以下条件之一):
(5)最大径<1cm的C-TIRADS 4B~5类甲状腺结节若存在以下情况之一,需行FNAB:①拟行手术或消融治疗前。②可疑结节呈多灶性或紧邻被膜、气管、喉返神经等。③伴颈部淋巴结可疑转移。④伴血清降钙素水平异常升高。⑤有甲状腺癌家族史或甲状腺癌综合征病史。
目前,FNAB的细胞学诊断采用2017版甲状腺细胞病理学Bethesda报告系统(TBSRTC)。在此报告系统中,细胞学诊断分为6级:Ⅰ级,不能诊断/不满意;Ⅱ级,良性;Ⅲ级,意义不明的非典型细胞/意义不明的滤泡性病变;Ⅳ级,滤泡性肿瘤/可疑滤泡性肿瘤;Ⅴ级,可疑恶性;Ⅵ级,恶性。不同细胞学诊断分级的患者其恶性风险不同,临床处理措施也不同(表2)。其中,Ⅲ级和Ⅳ级是建议采用分子检测手段进一步确诊。如BRAF突变、RAS突变、RET/PTC重排等,有助于提高确诊率。
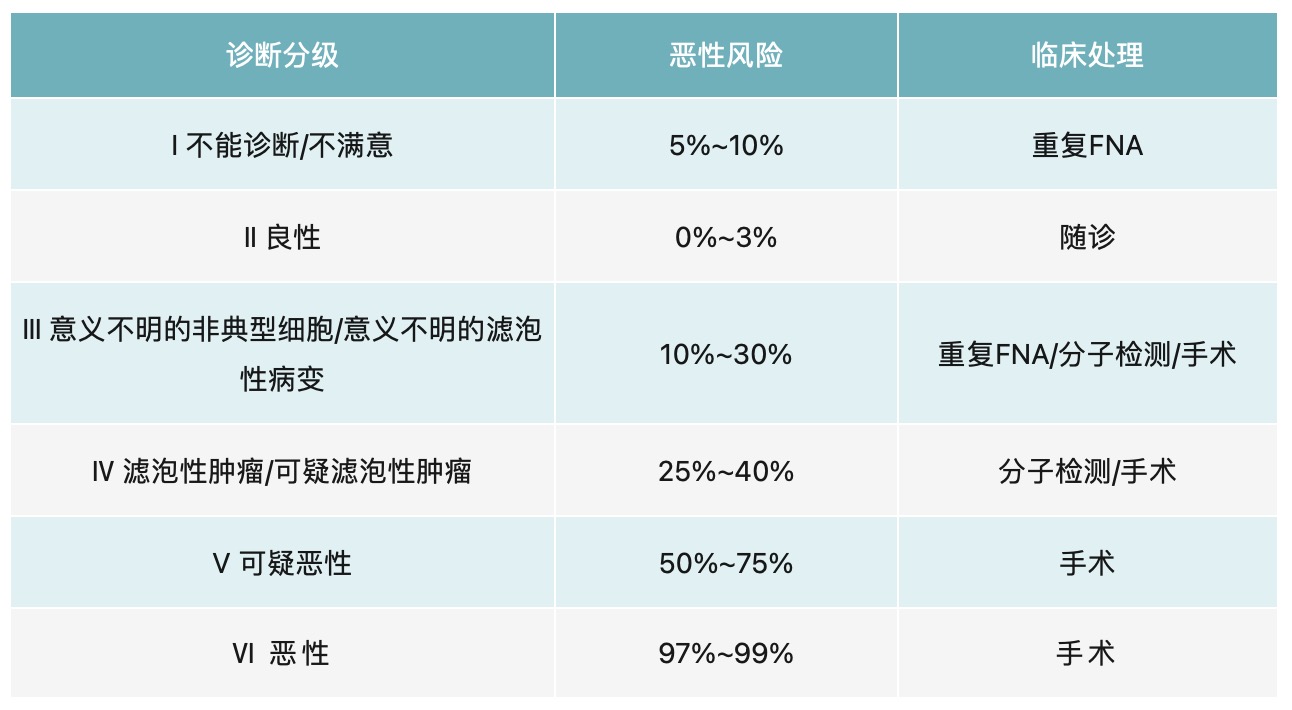
表2 TBSRTC 各诊断分级的恶性风险及临床处理[2]
经FNAB仍不能确定良恶性的甲状腺结节,或需要危险分层的恶性甲状腺结节,可以对穿刺标本进行分子标志物检测,可以避免不必要的手术[1]。
BRAFV600E突变在甲状腺FNA细胞病理中研究得最多[3],乳头状甲状腺癌(PTC)突变率可达 80%,在亚洲人群中,BRAFV600E突变率甚至更高。BRAFV600E在滤泡状甲状腺癌(FTC)中较少突变,在良性结节罕见突变。
因此,BRAFV600E突变是PTC非常重要的肿瘤标志物,BRAFV600E突变甲状腺结节恶性风险达到99.8%。一项纳入9924个FNAB样本的meta分析证实,BRAFV600E突变诊断PTC的特异度为100%,灵敏性为69%[4]。BRAFV600E突变虽然特异性很高但仍无法排除非阳性中的恶性倾向,尤其对于FTC。
ThyroSeq V3和Afirma基因分类器包含了更多的分子标志物,后者主要基于穿刺样本的RNA检测。近期一项前瞻性研究比较了ThyroSeq V3和Afrima基因分类器对于Ⅲ类和Ⅳ类结节的诊断效率,发现两者的阴性预测率分别为61%和53%,均使近50%的患者避免了诊断性手术,作者对分子诊断良性的患者进行了1年的超声随访,证实结节性质稳定[5]。
分子诊断在协助细胞学提高甲状腺结节的良恶性判定,以及对恶性甲状腺结节的危险分层方面,具有很好的前景,但需要更多的数据支持。
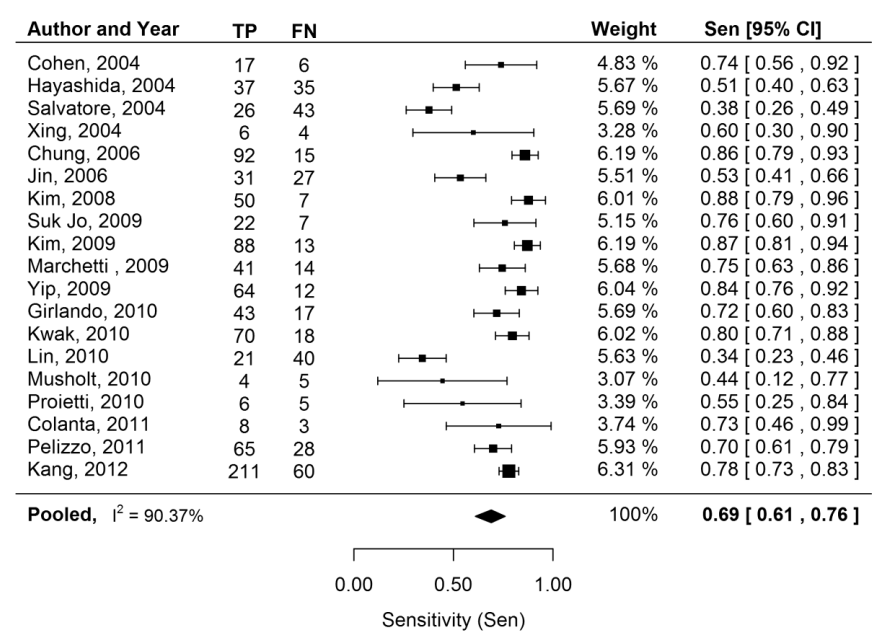
图1 BRAFV600E在PTC中的灵敏性[4]
因此,如何更加精准诊断甲状腺结节良恶性,从甲状腺癌的生物学角度,特别是从分子层面认识甲状腺癌的发病机制,甄别低风险甲状腺癌和高风险甲状腺癌,以便明确诊断和科学地分类个体化管理,避免过度治疗,同时也兼顾规范彻底治疗,建立精准、规范化、个体化的管理模式势在必行。
♦ 蛋白组学驱动的精准医学
蛋白质是生命活动的直接执行者,驱动人体组织和器官的结构、功能和调节。
与静态的基因组相比,蛋白组记录了细胞、组织或生物体水平随时间的变化,与转录组相比又有着更好的稳定性。因此,蛋白质组学为研究与健康和疾病相关的潜在系统生物学提供了强大的资源,揭示了潜在的生物标志物和药物靶点。
而精准医学和蛋白质组学的结合使精准肿瘤学有更多的机会在分子水平上理解致癌和治疗靶点的复杂机制,揭示用于检测和监测的潜在新生物标志物。随着人类基因组计划的最初宣布,人们立即意识到,必须补充人类蛋白质组,以全面了解人类健康和疾病背后的病理生理机制,利用这些知识来推进健康治疗,癌症被认为是一个主要优先事项。
为了实现这一目标,制定了许多举措,包括人类蛋白质组织(HUPO)、国家癌症研究所的临床蛋白质组学肿瘤分析联盟(CPTAC)、早期检测研究网络(EDRN)和监测流行病学结果数据库(SEER)、应用蛋白质基因组学组织学习和结果(APOLLO)、网络和国际癌症蛋白质基因组联盟(ICPC:癌症登月计划)等[7]。蛋白组学在癌症精准医疗中的潜在价值在日益凸显。
质谱(MS)仍然是目前用于蛋白质组学分析的关键平台,霰弹枪式的非靶向模式是最常用的方式。基于MS蛋白质组学主要依赖于三个领域的发展:样品预处理、检测分析和数据分析。
近年来,随着质量精度、速度和分辨率的提高,MS仪器取得了许多进展。更强大的MS仪器允许在几十分钟的时间范围内对蛋白质组进行深度挖掘。特别是用于灵敏定量分析的技术已经成熟,数据独立分析(DIA)方法以全息扫描的方式能够实现样品的重复分析,其高重现性在许多实验室间和实验室内的数据中得到了验证。
在靶向蛋白质组学(SRM/MRM/PRM)中,代表目标蛋白质的蛋白肽用于开发目标蛋白质或蛋白质组合的快速灵敏检测,这特别适用于生物标志物的检测分析。借助压力循环技术(PCT)建立的微量样本预处理体系[7,8],可实现低至0.1mg冷冻组织或石蜡包埋组织的高效、高通量和高重现性蛋白质多肽制备,将使得更多的临床样本能够有效开展蛋白组检测分析。
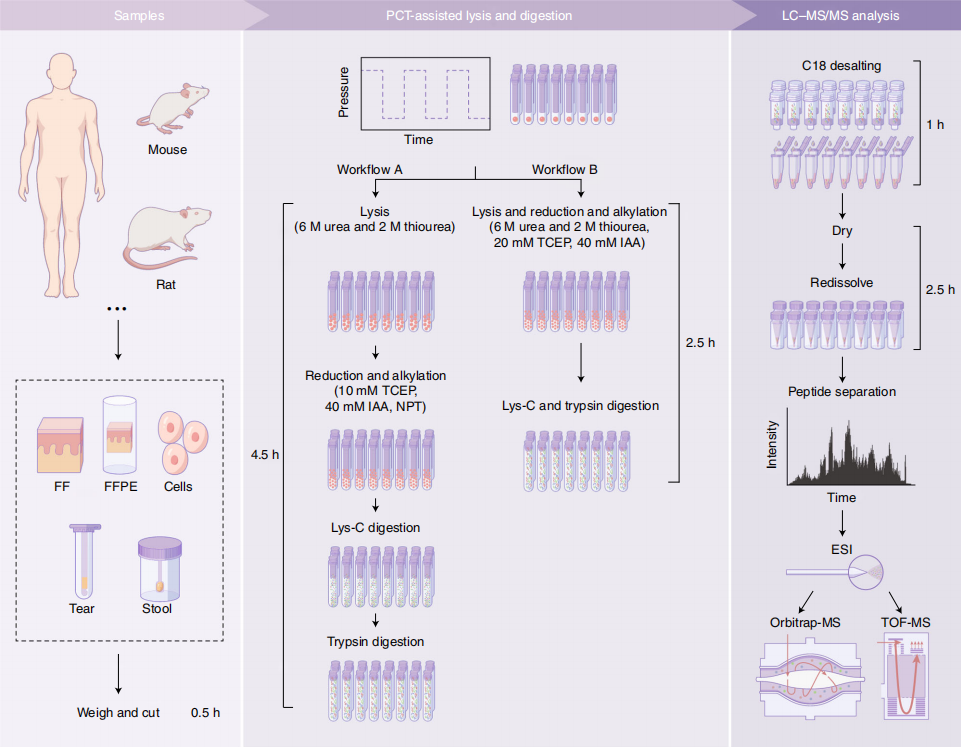
图2. 基于PCT样本制备的蛋白组分析方法流程[8]
♦ 基于蛋白组的甲状腺结节良恶性判别模型
2022年9月,西湖大学研究团队和西湖欧米联合国内外多家临床单对1724个甲状腺结节的石蜡包埋样本进行了蛋白组学分析[9]。
通过PCT-DIA方法采集蛋白质定量表达数据,构建了涵盖五种组织类型的甲状腺与甲状腺结节蛋白质组表达图谱。借助人工智能神经网络算法构建基于蛋白质组特征的甲状腺结节的良恶性判别模型。该模型在发现集中评估准确率高达91%。
并且,在回顾性测试集(288例石蜡样本)与前瞻性测试集(294例穿刺样本)中,模型对甲状腺结节的分类准确率分别高达89%和85%。该研究为基于蛋白组的甲状腺结节良恶性分子诊断方法开发提供了研究基础,也展示了高通量蛋白质组学与Al技术的深度碰撞。
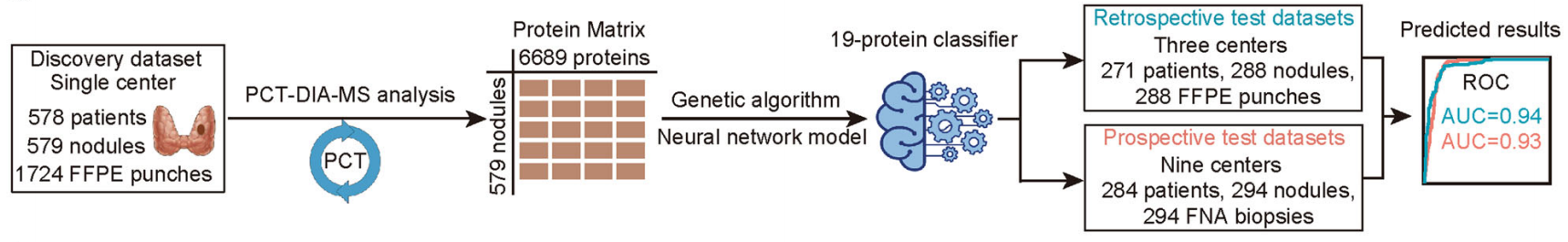
图3. AI赋能的蛋白组学建立甲状腺结节良恶性判别模型的研究设计
在此基础上,西湖欧米利用AI技术在蛋白组学大数据中筛选出14种与甲状腺/肿瘤发生发展相关的蛋白质表达特征(如ANXA1、HSPB1、COL1A1、APOE、LMNA、S10A6等),并结合BRAFV600E 突变的情况与患者临床资料建立了甲状腺结节良恶性判别的AI模型—— “甲谱诺ThyroProt™”。将更加精准的辅助临床医生对甲状腺结节良恶性进行甄别,也是首次真正意义上实现了蛋白组学在临床诊断应用中的转化。
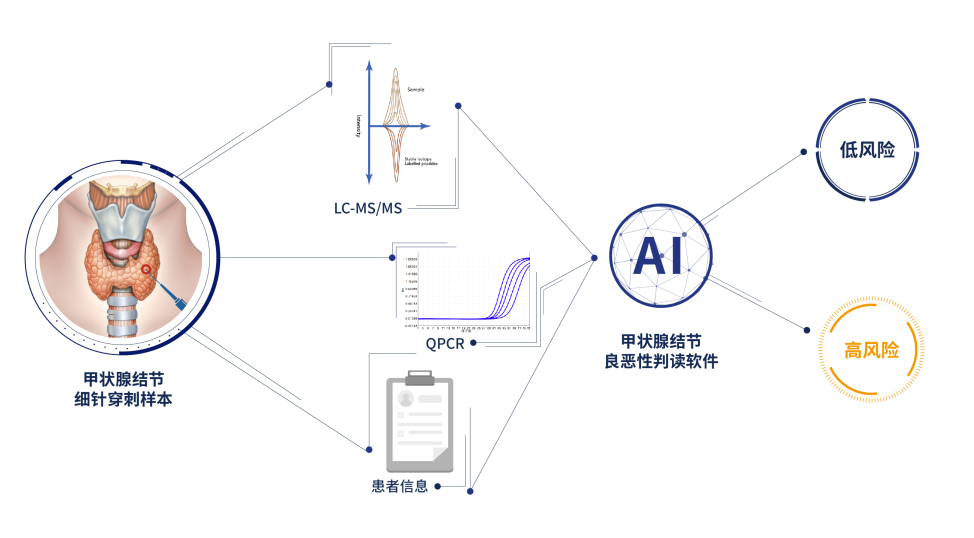
图4. 甲谱诺ThyroProt™方法流程
♦ 展望
我们期待蛋白组学驱动的精准医学将在甲状腺癌的良恶性诊断、亚型鉴别、治疗指导以及预后评估中发挥更大的价值,也更期待蛋白组学驱动的精准医学在其它肿瘤或疾病中大放异彩,为肿瘤或其它疾病建立精准、规范化、个体化的管理模式提供新的有效途径。
参考文献:
[1] 中华医学会内分泌学分会, 中华医学会外科学分会甲状腺及代谢外科学组, 中国抗癌协会头颈肿瘤专业委员会, 等. 甲状腺结节和分化型甲状腺癌诊治指南(第二版). 中华内分泌代谢杂志, 2023; 39(3):181-226.
[2] 甲状腺癌诊疗指南(2022年版). 中国实用外科杂志, 2022; 12:1343-1357.
[3] 罗定远, 廖健伟.甲状腺癌基因检测与临床应用广东专家共识(2020版).中华普通外科学文献, 2020; 14(3): 161-168.
[4] Naif Fnais, Charlene Soobiah, Khalid Al-Qahtani, et al. Diagnostic value of fine needle aspiration BRAF(V600E) mutation analysis in papillary thyroid cancer: a systematic review and meta-analysis.Hum Pathol. 2015;46(10):1443-54.
[5] Trial Masha J Livhits, Catherine Y Zhu, Eric J Kuo, et al. Effectiveness of Molecular Testing Techniques for Diagnosis of Indeterminate Thyroid Nodules: A Randomized Clinical. JAMA Oncol. 2021;7(1):70-77.
[6] Miao Su, Zhe Zhang, Li Zhou, et al. Proteomics, Personalized Medicine and Cancer. Cancers (Basel). 2021;13(11):2512.
[7] Tiannan Guo, Petri Kouvonen, Ching Chiek Koh, et al. Rapid mass spectrometric conversion of tissue biopsy samples into permanent quantitative digital proteome maps. Nat Med. 2015;21(4):407-13.
[8] Xue Cai, Zhangzhi Xue, Chunlong Wu, et al. High-throughput proteomic sample preparation using pressure cycling technology.Nat Protoc. 2022;17(10):2307-2325.
[9] Yaoting Sun, Sathiyamoorthy Selvarajan, Zelin Zang, et al. Artificial intelligence defines protein-based classification of thyroid nodules.Cell Discov. 2022;8(1):85.

甲谱诺ThyroProt™ 是基于液相色谱-串联质谱(LC-MS/MS)技术和荧光PCR技术,对甲状腺结节细针穿刺活检样本中14种与甲状腺/肿瘤发生发展相关的蛋白定量及可能的BRAFV600E突变进行检测。以上各项检测结果结合患者临床特征,使用包含人工智能算法技术的甲状腺结节良恶性分析软件分析并计算综合评分,对样本呈现的甲状腺结节良恶性风险进行判断。

♦ 甲状腺结节及良恶性诊断现状
甲状腺结节是常见病,在中国成人中通过超声检查发现直径0.5cm以上甲状腺结节的患病率达到20.43%,其中8%-16%为恶性肿瘤[1]。近年来,我国甲状腺癌发病率显著增加,尽管甲状腺癌整体恶性程度较低,但是仍然威胁患者的生命健康及生活质量。临床工作的重点是如何将甲状腺癌从高发的甲状腺结节中甄别出来,从而选择合理的治疗策略。
高分辨率超声是评估甲状腺结节最重要的影像学检查手段,对所有已知或怀疑的甲状腺结节均首选行超声检查[1]。通过颈部超声检查,可确定结节大小、数量、位置、囊实性、形状、边界、钙化、血供及周围组织的关系。同时评估颈部有无异常淋巴结及其部位、大小、形态、血流和结构特点等。
甲状腺影像报告和数据系统(TI-RADS)对甲状腺结节恶性程度进行评估,有助于规范甲状腺超声报告。中国版甲状腺影像报告与数据系统(C-TIRADS)简单易行,较适用于中国人群(表1)。其中超声检查难以明确良恶性结节,可借助超声引导下细针抽吸活检(FNAB)获取细胞成分,通过细胞学诊断病灶性质。

表1 超声评估甲状腺结节的TI-RADS分类[1]
FNAB是通过细针抽吸获取甲状腺结节的病变细胞进行病理学诊断,准确、经济、有效,是甲状腺结节术前首选的病理诊断方法[1]。超声引导甲状腺结节FNAB的适应证(符合以下条件之一):
(5)最大径<1cm的C-TIRADS 4B~5类甲状腺结节若存在以下情况之一,需行FNAB:①拟行手术或消融治疗前。②可疑结节呈多灶性或紧邻被膜、气管、喉返神经等。③伴颈部淋巴结可疑转移。④伴血清降钙素水平异常升高。⑤有甲状腺癌家族史或甲状腺癌综合征病史。
目前,FNAB的细胞学诊断采用2017版甲状腺细胞病理学Bethesda报告系统(TBSRTC)。在此报告系统中,细胞学诊断分为6级:Ⅰ级,不能诊断/不满意;Ⅱ级,良性;Ⅲ级,意义不明的非典型细胞/意义不明的滤泡性病变;Ⅳ级,滤泡性肿瘤/可疑滤泡性肿瘤;Ⅴ级,可疑恶性;Ⅵ级,恶性。不同细胞学诊断分级的患者其恶性风险不同,临床处理措施也不同(表2)。其中,Ⅲ级和Ⅳ级是建议采用分子检测手段进一步确诊。如BRAF突变、RAS突变、RET/PTC重排等,有助于提高确诊率。

表2 TBSRTC 各诊断分级的恶性风险及临床处理[2]
经FNAB仍不能确定良恶性的甲状腺结节,或需要危险分层的恶性甲状腺结节,可以对穿刺标本进行分子标志物检测,可以避免不必要的手术[1]。
BRAFV600E突变在甲状腺FNA细胞病理中研究得最多[3],乳头状甲状腺癌(PTC)突变率可达 80%,在亚洲人群中,BRAFV600E突变率甚至更高。BRAFV600E在滤泡状甲状腺癌(FTC)中较少突变,在良性结节罕见突变。
因此,BRAFV600E突变是PTC非常重要的肿瘤标志物,BRAFV600E突变甲状腺结节恶性风险达到99.8%。一项纳入9924个FNAB样本的meta分析证实,BRAFV600E突变诊断PTC的特异度为100%,灵敏性为69%[4]。BRAFV600E突变虽然特异性很高但仍无法排除非阳性中的恶性倾向,尤其对于FTC。
ThyroSeq V3和Afirma基因分类器包含了更多的分子标志物,后者主要基于穿刺样本的RNA检测。近期一项前瞻性研究比较了ThyroSeq V3和Afrima基因分类器对于Ⅲ类和Ⅳ类结节的诊断效率,发现两者的阴性预测率分别为61%和53%,均使近50%的患者避免了诊断性手术,作者对分子诊断良性的患者进行了1年的超声随访,证实结节性质稳定[5]。
分子诊断在协助细胞学提高甲状腺结节的良恶性判定,以及对恶性甲状腺结节的危险分层方面,具有很好的前景,但需要更多的数据支持。

图1 BRAFV600E在PTC中的灵敏性[4]
因此,如何更加精准诊断甲状腺结节良恶性,从甲状腺癌的生物学角度,特别是从分子层面认识甲状腺癌的发病机制,甄别低风险甲状腺癌和高风险甲状腺癌,以便明确诊断和科学地分类个体化管理,避免过度治疗,同时也兼顾规范彻底治疗,建立精准、规范化、个体化的管理模式势在必行。
♦ 蛋白组学驱动的精准医学
蛋白质是生命活动的直接执行者,驱动人体组织和器官的结构、功能和调节。
与静态的基因组相比,蛋白组记录了细胞、组织或生物体水平随时间的变化,与转录组相比又有着更好的稳定性。因此,蛋白质组学为研究与健康和疾病相关的潜在系统生物学提供了强大的资源,揭示了潜在的生物标志物和药物靶点。
而精准医学和蛋白质组学的结合使精准肿瘤学有更多的机会在分子水平上理解致癌和治疗靶点的复杂机制,揭示用于检测和监测的潜在新生物标志物。随着人类基因组计划的最初宣布,人们立即意识到,必须补充人类蛋白质组,以全面了解人类健康和疾病背后的病理生理机制,利用这些知识来推进健康治疗,癌症被认为是一个主要优先事项。
为了实现这一目标,制定了许多举措,包括人类蛋白质组织(HUPO)、国家癌症研究所的临床蛋白质组学肿瘤分析联盟(CPTAC)、早期检测研究网络(EDRN)和监测流行病学结果数据库(SEER)、应用蛋白质基因组学组织学习和结果(APOLLO)、网络和国际癌症蛋白质基因组联盟(ICPC:癌症登月计划)等[7]。蛋白组学在癌症精准医疗中的潜在价值在日益凸显。
质谱(MS)仍然是目前用于蛋白质组学分析的关键平台,霰弹枪式的非靶向模式是最常用的方式。基于MS蛋白质组学主要依赖于三个领域的发展:样品预处理、检测分析和数据分析。
近年来,随着质量精度、速度和分辨率的提高,MS仪器取得了许多进展。更强大的MS仪器允许在几十分钟的时间范围内对蛋白质组进行深度挖掘。特别是用于灵敏定量分析的技术已经成熟,数据独立分析(DIA)方法以全息扫描的方式能够实现样品的重复分析,其高重现性在许多实验室间和实验室内的数据中得到了验证。
在靶向蛋白质组学(SRM/MRM/PRM)中,代表目标蛋白质的蛋白肽用于开发目标蛋白质或蛋白质组合的快速灵敏检测,这特别适用于生物标志物的检测分析。借助压力循环技术(PCT)建立的微量样本预处理体系[7,8],可实现低至0.1mg冷冻组织或石蜡包埋组织的高效、高通量和高重现性蛋白质多肽制备,将使得更多的临床样本能够有效开展蛋白组检测分析。

图2. 基于PCT样本制备的蛋白组分析方法流程[8]
♦ 基于蛋白组的甲状腺结节良恶性判别模型
2022年9月,西湖大学研究团队和西湖欧米联合国内外多家临床单对1724个甲状腺结节的石蜡包埋样本进行了蛋白组学分析[9]。
通过PCT-DIA方法采集蛋白质定量表达数据,构建了涵盖五种组织类型的甲状腺与甲状腺结节蛋白质组表达图谱。借助人工智能神经网络算法构建基于蛋白质组特征的甲状腺结节的良恶性判别模型。该模型在发现集中评估准确率高达91%。
并且,在回顾性测试集(288例石蜡样本)与前瞻性测试集(294例穿刺样本)中,模型对甲状腺结节的分类准确率分别高达89%和85%。该研究为基于蛋白组的甲状腺结节良恶性分子诊断方法开发提供了研究基础,也展示了高通量蛋白质组学与Al技术的深度碰撞。

图3. AI赋能的蛋白组学建立甲状腺结节良恶性判别模型的研究设计
在此基础上,西湖欧米利用AI技术在蛋白组学大数据中筛选出14种与甲状腺/肿瘤发生发展相关的蛋白质表达特征(如ANXA1、HSPB1、COL1A1、APOE、LMNA、S10A6等),并结合BRAFV600E 突变的情况与患者临床资料建立了甲状腺结节良恶性判别的AI模型—— “甲谱诺ThyroProt™”。将更加精准的辅助临床医生对甲状腺结节良恶性进行甄别,也是首次真正意义上实现了蛋白组学在临床诊断应用中的转化。

图4. 甲谱诺ThyroProt™方法流程
♦ 展望
我们期待蛋白组学驱动的精准医学将在甲状腺癌的良恶性诊断、亚型鉴别、治疗指导以及预后评估中发挥更大的价值,也更期待蛋白组学驱动的精准医学在其它肿瘤或疾病中大放异彩,为肿瘤或其它疾病建立精准、规范化、个体化的管理模式提供新的有效途径。
参考文献:
[1] 中华医学会内分泌学分会, 中华医学会外科学分会甲状腺及代谢外科学组, 中国抗癌协会头颈肿瘤专业委员会, 等. 甲状腺结节和分化型甲状腺癌诊治指南(第二版). 中华内分泌代谢杂志, 2023; 39(3):181-226.
[2] 甲状腺癌诊疗指南(2022年版). 中国实用外科杂志, 2022; 12:1343-1357.
[3] 罗定远, 廖健伟.甲状腺癌基因检测与临床应用广东专家共识(2020版).中华普通外科学文献, 2020; 14(3): 161-168.
[4] Naif Fnais, Charlene Soobiah, Khalid Al-Qahtani, et al. Diagnostic value of fine needle aspiration BRAF(V600E) mutation analysis in papillary thyroid cancer: a systematic review and meta-analysis.Hum Pathol. 2015;46(10):1443-54.
[5] Trial Masha J Livhits, Catherine Y Zhu, Eric J Kuo, et al. Effectiveness of Molecular Testing Techniques for Diagnosis of Indeterminate Thyroid Nodules: A Randomized Clinical. JAMA Oncol. 2021;7(1):70-77.
[6] Miao Su, Zhe Zhang, Li Zhou, et al. Proteomics, Personalized Medicine and Cancer. Cancers (Basel). 2021;13(11):2512.
[7] Tiannan Guo, Petri Kouvonen, Ching Chiek Koh, et al. Rapid mass spectrometric conversion of tissue biopsy samples into permanent quantitative digital proteome maps. Nat Med. 2015;21(4):407-13.
[8] Xue Cai, Zhangzhi Xue, Chunlong Wu, et al. High-throughput proteomic sample preparation using pressure cycling technology.Nat Protoc. 2022;17(10):2307-2325.
[9] Yaoting Sun, Sathiyamoorthy Selvarajan, Zelin Zang, et al. Artificial intelligence defines protein-based classification of thyroid nodules.Cell Discov. 2022;8(1):85.