胚胎干细胞(ESCs)具有体外无限自我更新和向各种谱系分化的能力。深入理解ESCs多能性维持和命运决定机制对于推动多能干细胞的潜在临床应用具有重要的意义。
在多能性维持中,关键转录因子OCT4、SOX2和NANOG (OSN)发挥决定性作用。OSN通过形成自我表达调节环路维持自身的表达并相互协作,共同激活多能性基因同时抑制胚层分化基因的表达。既往研究表明,OCT4、SOX2和NANOG分别通过抑制滋养外胚层(TE)、中内胚层(ME)和原始内胚层(PE)谱系分化基因维持多能性。因此, OSN蛋白水平的精确调控对于ESCs的多能性维持非常重要。
此外,表观遗传因子多梳蛋白通过组装成两个抑制性复合物PRC1和PRC2,在染色质上形成抑制性组蛋白修饰沉默发育分化基因表达,协助OSN维持ESCs多能性。然而,哺乳动物细胞中PRC1组成十分复杂,不同的亚基形成了六个亚复合物(PRC1.1-PRC1.6)。其中,PRC1.1中的多个亚基被报道抑制ESCs中分化基因的表达参与多能性维持,但其去泛素化酶亚基USP7如何调控多能性转录网络仍然知之甚少。
为了探究USP7在mESCs维持中的功能,课题组首先利用shRNA敲降Usp7的表达,发现mESCs的多能性受损,并且伴随发育分化和细胞命运决定相关基因表达上调,表明USP7主要通过抑制谱系分化基因的表达维持mESCs的多能性(图1)。
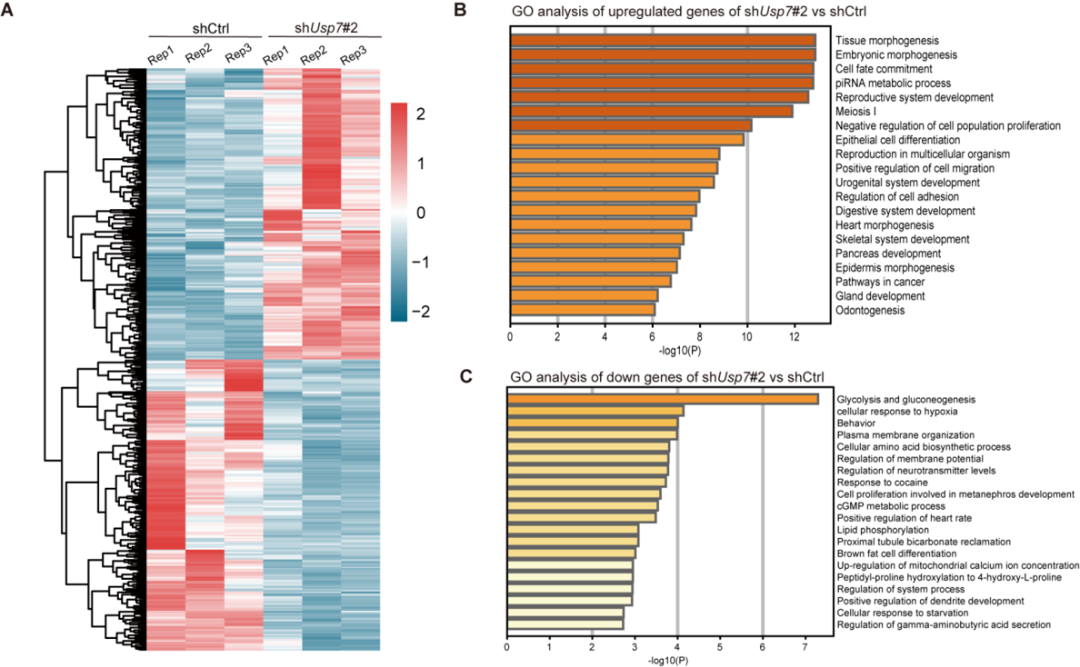
图1 USP7调控mESCs的基因表达网络
为了阐明USP7维持mESCs多能性的分子机制,课题组接下来利用质谱和免疫共沉淀等技术解析了USP7的互作蛋白,发现USP7与多个PRC1亚基如RING1B和RYBP及核心转录因子SOX2互作(图2)。

图2 USP7与PRC1亚基及SOX2互作
课题组通过构建USP7的截变体,失酶活点突变和蛋白半衰期等实验明确了USP7通过TRAF结构域与与PRC1核心亚基RYBP和SOX2互作,并维持SOX2蛋白的稳定性,进一步利用泛素化实验证明SOX2是USP7的去泛素化底物(图3)。
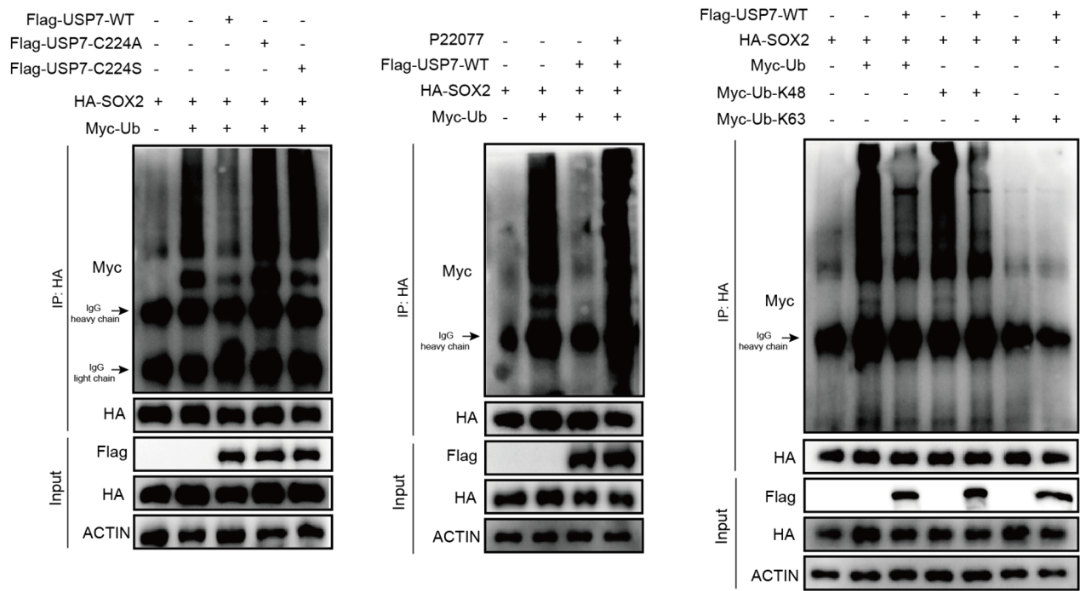
图3 SOX2是USP7的去泛素化底物
为了进一步解析USP7调控mESCs酶活依赖和非依赖的功能,课题组进一步构建了Usp7敲除mESCs中AID降解外源性Flag-USP7并过表达HA-野生型USP7(HA-USP7WT)或C224S酶活突变体(HA-USP7C224S)挽救系统,并利用RNA-seq发现USP7通过酶活依赖和非依赖功能抑制mESCs胚层分化基因表达(图4)。
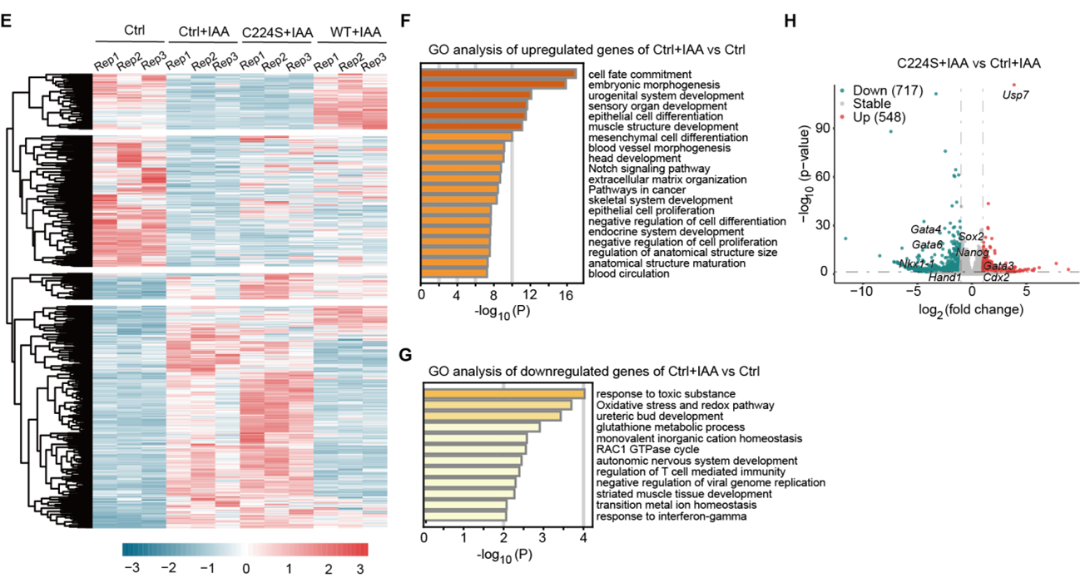
图4 USP7通过酶活依赖和非依赖的功能抑制mESCs胚层分化基因表达
课题组进一步利用CUT&Tag技术探究了USP7抑制mESCs胚层分化基因表达的分子机制,发现USP7通过维持H2AK119ub1-H3K27me3抑制性染色质沉默基因表达,并且缺失了去泛素化酶活性的USP7能够维持RYBP在染色质上抑制PE基因表达(图5)。
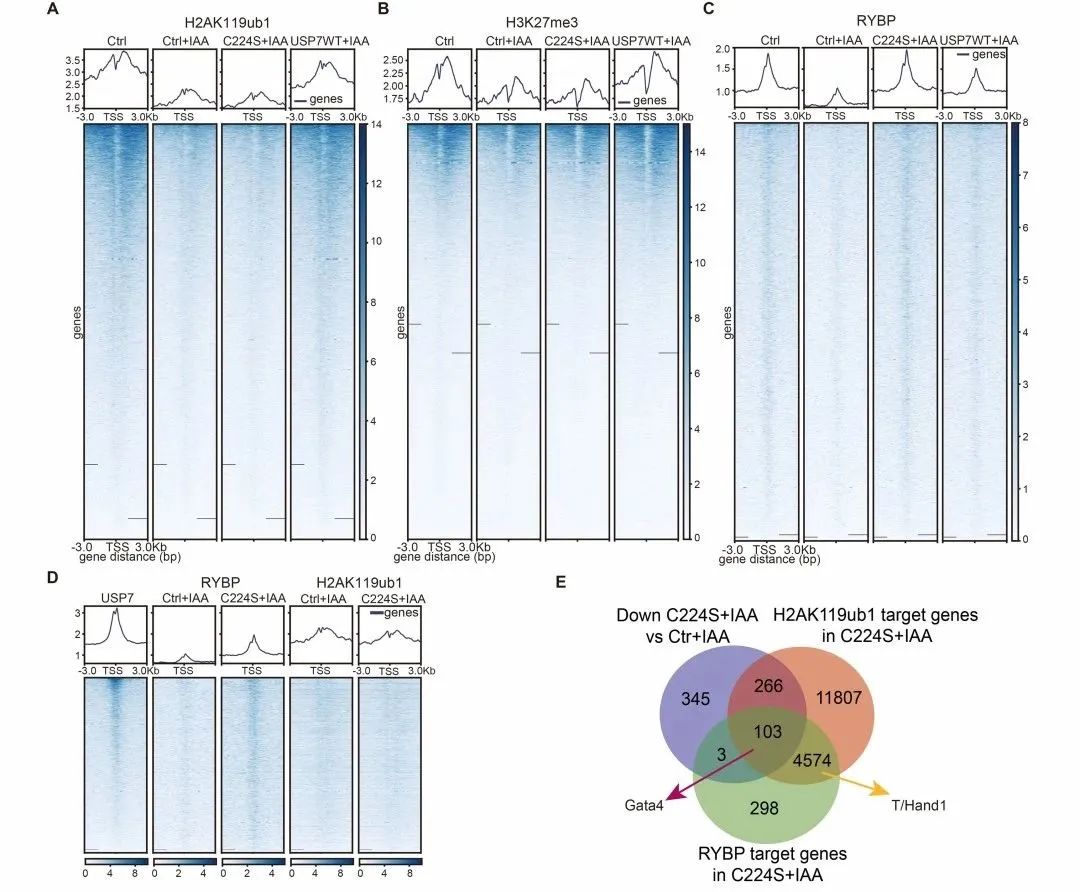
图5 缺失去泛素化酶活性的USP7能够维持RYBP在染色质上抑制PE基因表达
综上所述,本研究发现通过USP7通过去泛素化酶活性维持SOX2的表达,并维持多梳蛋白形成的抑制性组蛋白修饰,协同SOX2抑制ME基因表达。此外缺失去泛素化酶活性的USP7骨架能够维持RYBP在染色质,从而抑制PE基因表达(图6)。本研究发现了USP7在mESCs维持中去泛素化酶活性非依赖的非经典功能,为USP7在其它生物学过程如肿瘤中的研究提供了新的方向与思路。

图6 模型图
浙江大学基础医学院干细胞与再生医学专业、浙江大学-爱丁堡大学联合学院2017级博士生刘超、2016级博士生孙林刚为本文共同第一作者。浙江大学基础医学院纪俊峰教授为本文通讯作者。本研究得到西湖大学郭天南和朱怡、浙江大学王迪、孙启明、Dante Neculai、白戈和尹亚飞等教授的支持与帮助,并受到国家自然科学基金等资助。
原文链接:
https://www.science.org/doi/10.1126/sciadv.ade3888