蛋白质组学和磷酸蛋白质组学为免疫浸润和肿瘤免疫逃避反应背后的关键功能分子提供了独特的见解,而仅靠基因组方法往往无法完全理解这些分子。
2024年2月14日,CPTAC在Cell上发表了新的文章 Pan-cancer proteogenomics characterization of tumor immunity。

图1 论文截图
研究使用CPTAC泛癌蛋白质组数据全面表征了10种不同癌症的1,000多个肿瘤的免疫状况,探索了肿瘤微环境的多样性和免疫亚型,揭示了与肿瘤形态学和分子特征相关的免疫亚型,并发现了潜在的治疗靶点。
研究人员在美国国家癌症研究所支持的CPTAC(临床蛋白质组肿瘤分析联盟,Clinical Proteomic Tumor Analysis Consortium)最近的蛋白质组学研究中,分析了来自10种癌症患者的1,056个未经治疗的样本,采用了包括全基因组测序(WGS)、RNA-seq、定量蛋白质组学和磷酸化蛋白质组学在内的蛋白质组学方法。
样本类型包括乳腺癌(BC,n=113)、透明细胞肾细胞癌(CCRCC,n=103)、结肠癌(CO,n=96)、胶质母细胞瘤(GBM,n=99)、头颈部鳞状细胞癌 (HNSCC,n=110)、肺鳞癌 (LSCC,n=108)、肺腺癌 (LUAD,n=110)、卵巢癌 (OV,n=82)、胰腺导管腺癌 (PDAC,n=140)和子宫内膜癌 (UCEC,n=95)。
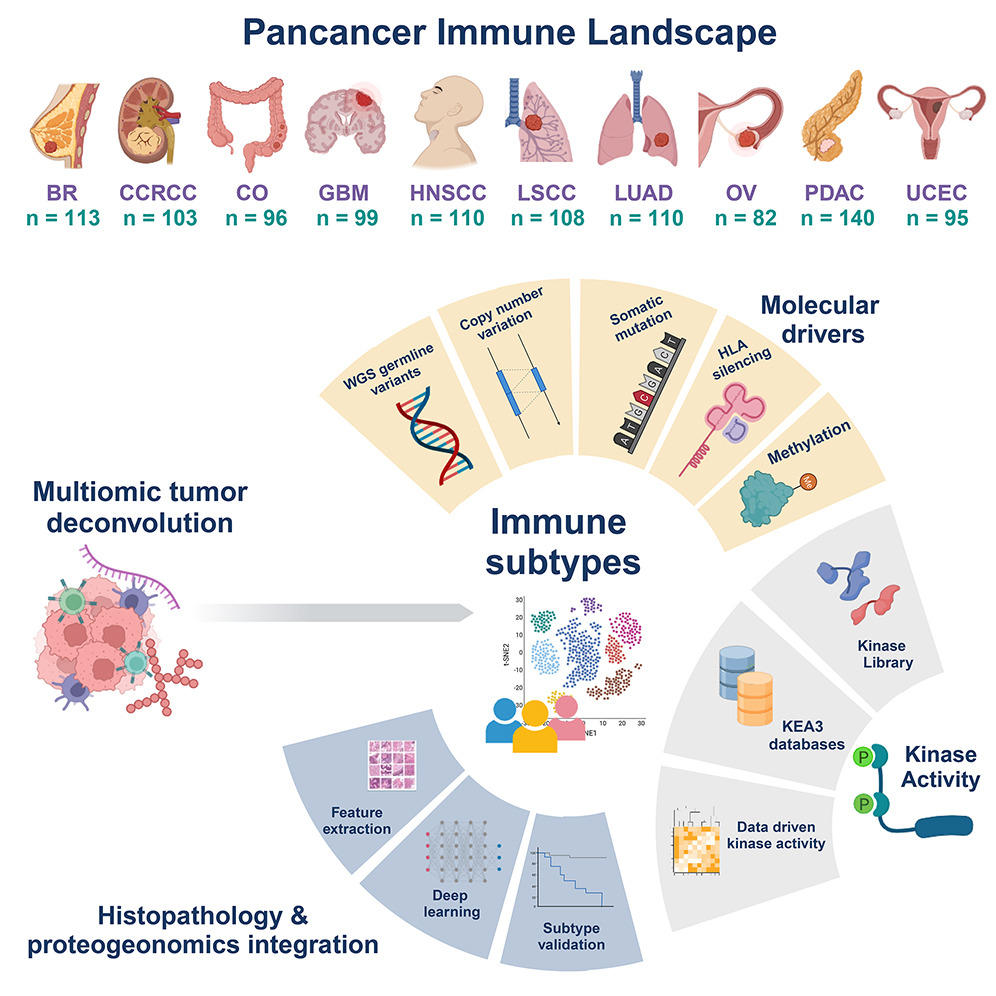
图2 图文摘要
结果1:
细胞类型组成异质性及其与患者预后的关联
泛癌在肿瘤细胞百分比以及免疫和基质细胞百分比方面表现出显著的异质性。具体来说,CCRCC、LUAD和PDAC显示出最高的免疫浸润,而CCRCC和PDAC也相对于其他癌症表现出更高的基质成分。相反,UCEC显示出最高的肿瘤细胞百分比,但免疫和基质组成最低。
为了了解这些肿瘤中不同免疫/基质细胞类型的浸润模式,研究人员使用最近开发的一个解卷积算法估算了肿瘤微环境中的细胞类型组成分数,比较了不同肿瘤中的细胞类型分数,揭示了不同癌症之间细胞类型组成的广泛异质性。
结果2:
涵盖10种癌症的免疫亚型
除了细胞类型分数外,研究人员还利用了来自文献的427个免疫相关特征,对CPTAC的肿瘤微环境(TME)进行了表征。
他们首先将这些免疫相关特征分为10个不同的免疫模块,然后根据它们在蛋白质组学数据中的单样本基因集富集分数,得出每个肿瘤样本的模块活性评分,利用它们与细胞类型分数共同进行共识聚类,检测具有不同TME的免疫亚型。最终识别了七个簇:CD8+/IFNG+、嗜酸性粒细胞/内皮细胞、成纤维细胞/TGF-β、CCRCC/内皮细胞、脑/神经、CD8−/IFNG+和CD8−/IFNG−,并探究了它们之间的特征和关联,以及与人口学变量的相关性。
结果3:
免疫亚型与治疗反应之间的关联
为了探索免疫亚型与癌症治疗反应之间的关联,研究人员使用了来自第三期OAK临床试验(NCT02008227)的数据,该试验涉及425例接受免疫治疗(atezolizumab/MPDL3280A)的非小细胞肺癌患者。
研究人员从344名患者的治疗前肿瘤组织中获取了RNA-seq数据。通过利用基于CPTAC法癌RNA-seq数据上训练的免疫亚型预测模型,他们确定了344个肿瘤中的75个属于CD8+/IFNG+亚型,这些患者显示出明显更好的无进展生存期(PFS)。在OAK试验中接受化疗(Docetaxel)的独立患者组(n=355)中未检测到这种关联。这些发现与研究人员的预期一致,支持了CD8+/IFNG+亚型在免疫治疗中的增强反应。
结果4:
细胞类型组成和免疫亚型的验证
为了验证免疫组成估计和推断的免疫亚型,研究人员使用了可用的FFPE块对一部分肿瘤进行了替代实验平台的分析,包括免疫组化(IHC)、质谱多反应监测(MRM)和组织微阵列(TMA)多重免疫荧光染色图像实验。
此外,他们利用了独立的CCRCC队列的最新蛋白质组学数据来确认在CCRCC中检测到的免疫亚型。验证结果显示,通过免疫组化和其他方法获得的细胞类型比例和免疫亚型具有良好的一致性,并且在独立的CCRCC队列中得到了验证。
结果5:
与现有免疫亚型的对比
研究人员将基于蛋白质组学的免疫亚型与TCGA泛癌研究识别的免疫亚型进行了比较。在将TCGA免疫亚型分类应用于CPTAC全癌种RNA-seq数据后,他们观察到CCRCC大部分分配给了炎症性亚型,HNSCC和OV分配给了干扰素γ主导亚型,GBM分配给了淋巴细胞耗竭亚型。与此相反,蛋白质组学分析提出了每种癌症内部的不同免疫特征,与现有文献报道的这些癌症之间的不同免疫景观一致。
与单一癌症研究相比,这一泛癌免疫亚型分析可以通过借用不同癌症的信息来识别新的免疫亚型。
结果6:
DNA畸变对免疫亚型的影响
突变基因型与免疫表型的关联:研究发现一组在癌症中频繁突变的基因与免疫表型(包括细胞类型比例、免疫通路模块和免疫亚型)之间存在显著关联。具体来说,STK11突变与CD8−/IFNG+呈正相关,而BAP1和CASP8突变与高免疫原性的亚型CD8+/IFNG+呈正相关。此外,还发现了其他未曾与肿瘤微环境相关的突变。例如,AXIN1突变与巨噬细胞和成纤维细胞/TGF-β亚型的存在相关联。
拷贝数变异与免疫表型的关联:研究发现染色体3p、4p、5p和9p等区域的基因拷贝数变异与CD8+ T细胞和巨噬细胞浸润密切相关。特别是,染色体3p上的基因拷贝数缺失与CCRCC肿瘤中CD8+ T细胞信号的负相关,以及CD8+ T细胞浸润与CCRCC患者的无进展生存期(PFS)的正相关。另外,染色体9p21上的基因拷贝数缺失与创伤愈合增殖模块的正相关,这可能导致TME的免疫抑制。
种系DNA变异有助于形成泛癌肿瘤微环境:多个研究表明,除了在癌症风险上的传统作用外,种系遗传变异在塑造TME中也起着重要作用。通过基因表达(eQTL)和蛋白质表达(pQTL)的数量性状位点(QTL)分析,揭示了重要的QTL调控基因(eGenes)和/或蛋白质(pProteins),其中包括多个免疫通路。
DNA甲基化与免疫亚型的关联:基于基因水平的DNA甲基化数据,研究人员发现一系列基因在其DNA甲基化与免疫亚型之间存在泛癌相关或癌症特异性关联。尤其值得关注的是,在HNSCC中,发现许多基因的DNA甲基化与CD8−/IFNG−呈负相关。值得注意的是,DNA甲基化与免疫亚型之间的关联通常与RNA/蛋白质表达与免疫亚型之间的关联方向相反。
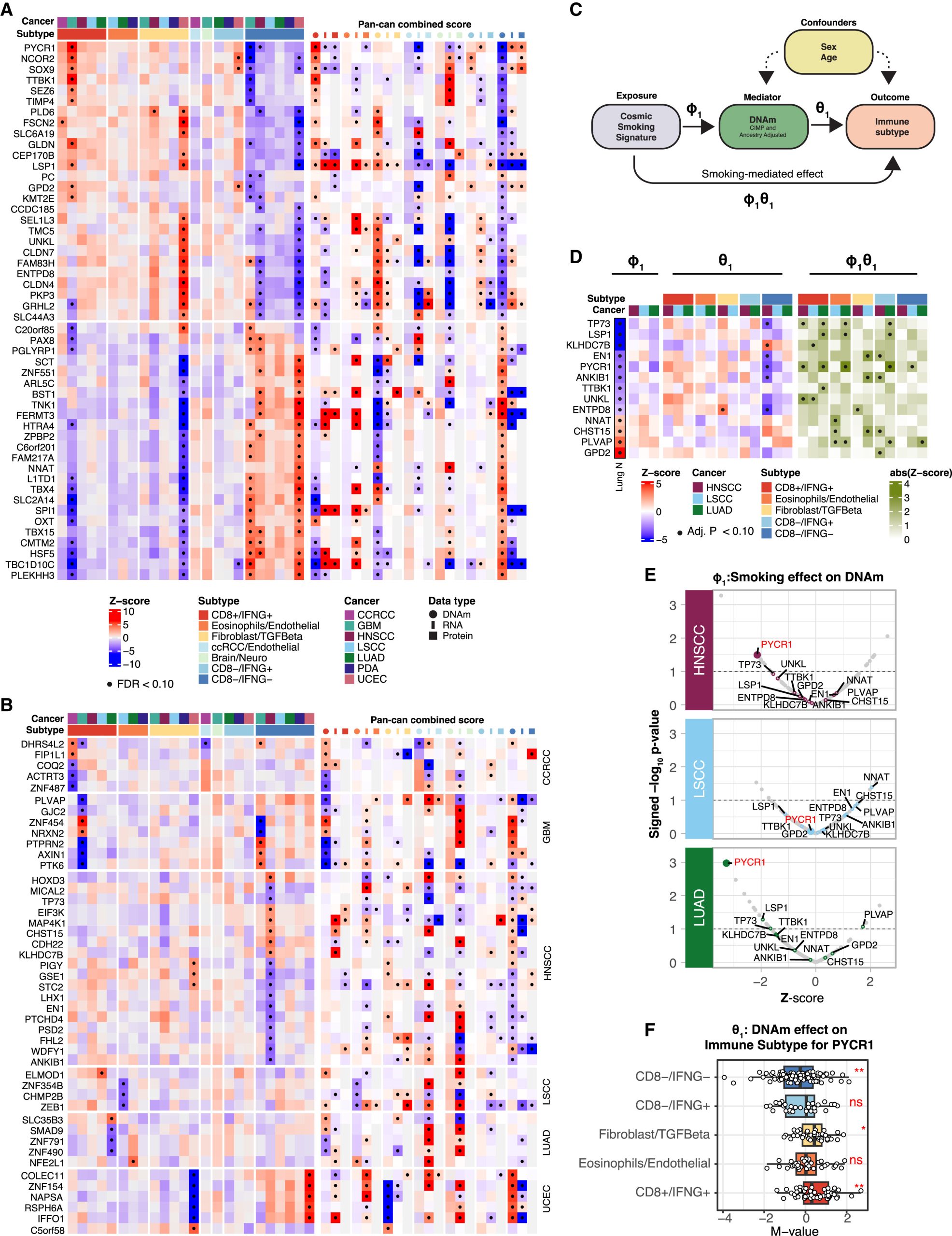
图3 免疫亚型与DNA甲基化的关联
吸烟对通过DNA甲基化介导的免疫亚型的影响:吸烟与表观遗传学的关联已经得到充分认可,而其对TME的影响是否通过表观遗传学改变介导则尚不清楚。通过中介分析发现,吸烟相关的DNA甲基化对于HNSCC、LSCC和LUAD中的TME具有显著的调节作用。
结果7:
不同免疫亚型中的激酶活化
通过磷酸蛋白质组学数据,揭示了在不同免疫亚型中激酶活化的重要性质,并提出了将低免疫原性(冷)肿瘤转变为高免疫原性(热)肿瘤的潜在靶点。
研究人员使用了激酶库和KEA3两种工具进行激酶活化特征化。通过这些工具发现了在CD8+/IFNG+中活化的激酶包括MAPKAPKs、IKKβ和TBK1,这些激酶在多种癌症中保持一致活化。另外,AKT激酶在高免疫原性肿瘤中也得到活化。而相反,细胞周期相关激酶如CDK1和CDK2在低免疫原性肿瘤中活化,提示这些肿瘤中更多的细胞正在活跃增殖。研究还发现一些激酶活性与其染色体核型变异相关联,这进一步揭示了激酶活性与免疫相关的调节可能存在的关联。
与免疫亚型有关的激酶和转录因子调控:研究发现特定激酶可以调节与免疫相关的转录因子活性,而与糖酵解相关的激酶抑制免疫相关途径。通过CRISPR-Cas敲除实验验证了这种关联,并提供了潜在的免疫调节治疗靶点。
与免疫亚型有关的细胞特异性激酶活化:研究发现,在不同的癌症中存在一致的激酶活化模式,冷瘤细胞通常显示较低的活化水平,而热瘤细胞则显示较高的活化水平,其中包括了一些重要的激酶如FYN、CDK19、CDK20和PTK2(FAK)。
结果8:
免疫亚型的组织病理学评估
研究人员利用数字化扫描的肿瘤H&E图像来构建用于预测免疫亚型的卷积神经网络模型。
研究发现,泛癌模型在大多数癌症中的表现优于组织特异性模型,显示出较好的预测能力。通过tSNE图和集成梯度基于显著性映射,揭示了影响模型决策的重要特征,如细胞形状、大小和核特征。
此外,通过分析肿瘤细胞的形态学特征与细胞因子表达特征的相关性,发现炎性细胞因子可能限制了肿瘤细胞的生长。最后,研究还训练了一个额外的泛癌模型来预测5种免疫亚型,其中对CD8+/INFG+、嗜酸性粒细胞/内皮细胞和CD8−/INFG−的预测效果较好。
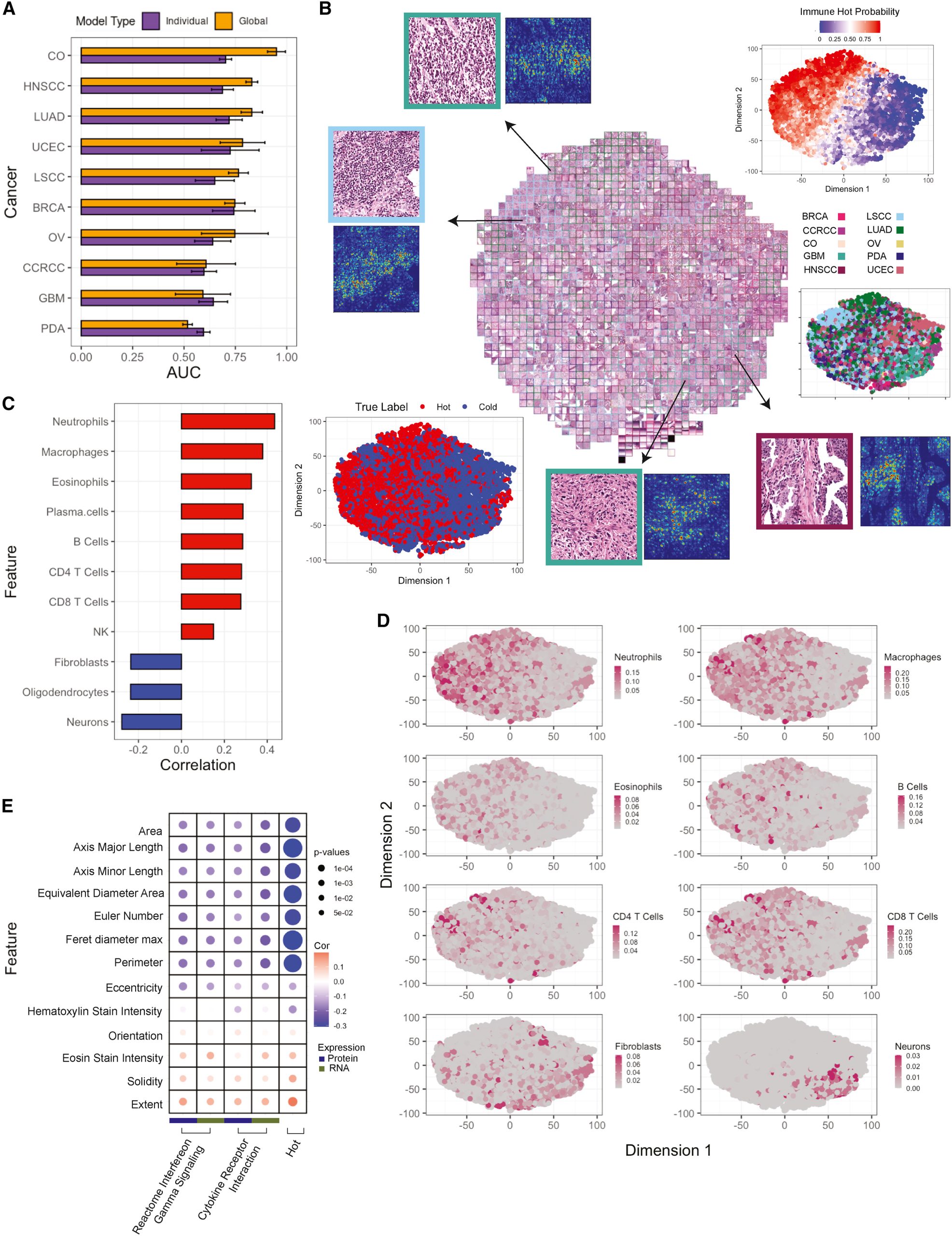
图4 免疫亚型的组织病理学评估
总 结
总的来说,研究人员分析了分析了10种癌症的1,000多个肿瘤样本的蛋白质组图谱以及匹配的基因组、表观基因组和转录组图谱,以全面表征这些肿瘤的免疫状况。
与仅基于基因组数据的相关工作相比,从蛋白质组学数据中得出的免疫亚型显示出在不同癌症内部和跨不同癌症之间增加了有意义的异质性。肿瘤组织图像数据对不同免疫亚型的可预测性定义了肿瘤形态学和分子特征之间的联系。利用磷酸蛋白质组学数据,研究人员还预测了与不同免疫表型相关的可靶向激酶。
该研究也存在一些局限性,包括CPTAC泛癌队列中缺乏详细的治疗信息,以及不同癌症内部和不同癌症之间广泛的样本异质性。
文章链接:
https://doi.org/10.1016/j.cell.2024.01.027








