
欧米行业动态
1 美多组学肿瘤早筛企业Freenome获18亿融资
文献目录
2 肾透明细胞癌的多组学分析发现与疾病进展相关的代谢重编程
3 COVID-19早期和晚期脑干、小脑和嗅觉组织的多组学分析
4 综合多组学分析揭示中国人群乳腺癌的患者分层和治疗脆弱性
5 血浆蛋白质组学特征预测健康成人未来痴呆症
6 阿尔茨海默病和癫痫中相似的脑蛋白质组学特征
7 绘制蛋白质基因组图谱以预测急性髓细胞白血病的药物反应
8 通过空间多维蛋白质组学揭示胶质瘤机制
一起来看看本周蛋白组学领域行业动态和精选优质文献吧!
1. 美多组学肿瘤早筛企业Freenome获18亿融资

当地时间2月15日,癌症检测生物技术公司Freenome宣布其再获2.54亿美元的私募融资(约合人民币18亿元)。本轮融资由罗氏(Roche)领投,据Freenome官网消息称,这笔资金将使其 “在多组学平台上推动单一癌症和定制的多癌症早期检测测试产品线”。
https://www.freenome.com/news/freenome-raises-254-million-in-new-funding-to-accelerate-its-platform-for-early-cancer-detection/#:~:text=SOUTH%20SAN%20FRANCISCO%2C%20CA%20(Feb,from%20new%20and%20existing%20investors.
2.(Nat Genet,IF: 30.8)肾透明细胞癌的多组学分析发现与疾病进展相关的代谢重编程

肾透明细胞癌(ccRCC)是一种复杂的疾病,具有显著的免疫和代谢异质性。研究人员对同济医院肾细胞癌(TJ-RCC)队列中的100名ccRCC患者进行了基因组学、转录组学、蛋白质组学、代谢组学和空间转录组学和代谢组学分析。
他们的分析确定了四种ccRCC亚型,包括去透明细胞分化(DCCD)-ccRCC,这是一种具有独特代谢特征的亚型。DCCD癌细胞以较少的脂滴、减少的代谢活性、增强的营养摄取能力和高增殖率为特征,导致预后不佳。使用单细胞和空间轨迹分析,研究人员证明DCCD是ccRCC进展的常见方式。即使在I期患者中,DCCD也与更差的预后和更高的复发率相关,表明它不能仅通过肾切除治愈。该研究还提出了一种基于亚型特异性免疫细胞浸润的治疗策略,可以指导ccRCC的临床管理。
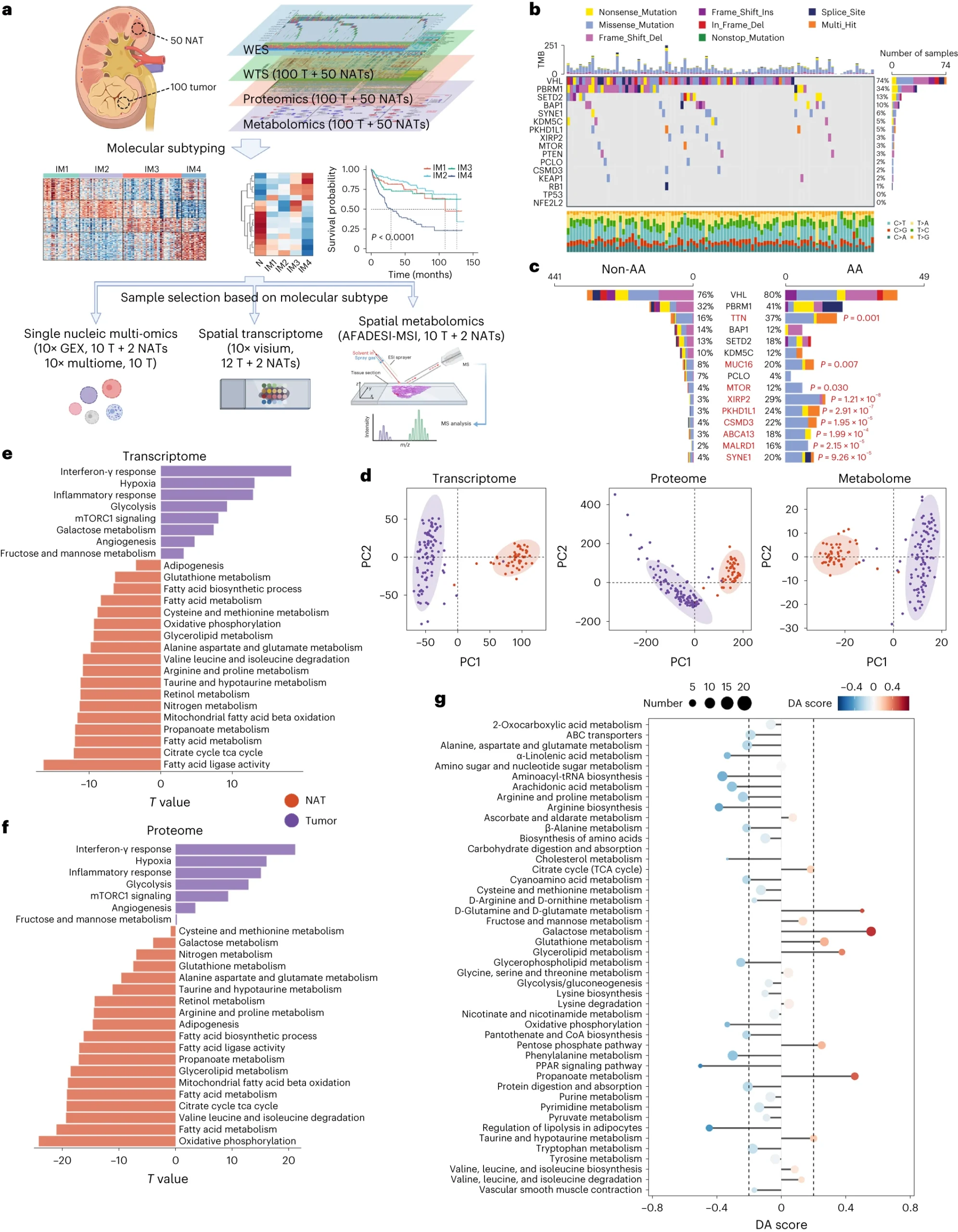
https://www.nature.com/articles/s41588-024-01662-5
3. (Nat Neurosci,IF: 25)COVID-19早期和晚期脑干、小脑和嗅觉组织的多组学分析

新型冠状病毒病(COVID-19)的急性感染阶段和后期都可能出现神经系统症状,包括认知障碍和疲劳,然而导致这些症状的机制仍不清楚。
研究人员对COVID-19不同阶段已故个体的脑干组织进行了单核转录组和蛋白质组分析。他们检测到急性COVID-19病例中的炎症型I干扰素反应,这种反应在疾病后期会消退。通过整合单核RNA测序和空间转录组学,研究人员能够将对严重全身性炎症的两种反应模式定位到位于颅神经核的神经反应和影响整个脑干的另一种弥漫性模式。后者反映了呼吸道感染的旁观者效应(bystander effect),该感染传播到整个血管单位并改变了主要少突胶质细胞、小胶质细胞和星形胶质细胞的转录状态,而脑干核的改变可能反映了免疫系统与中枢神经系统之间的连接(例如迷走神经)。
研究结果表明,即使在中枢神经系统中没有持续存在coronavirus 2,局部免疫反应仍然占主导地位,可能导致功能障碍,从而导致COVID-19的神经并发症。

https://www.nature.com/articles/s41593-024-01573-y
4.(Nat Cancer,IF: 22.7)综合多组学分析揭示中国人群乳腺癌的患者分类和治疗脆弱性

研究人员建立了一个包括773名中国乳腺癌患者的综合多组学队列,并系统分析了他们的基因组学、转录组学、蛋白质组学、代谢组学、放射组学和数字病理学特征。研究显示,与白人乳腺癌相比,亚洲个体具有更多可靶向AKT1突变。综合分析揭示了中国HR+HER2+队列中HER2富集亚型的比例较高;相应地,ERBB2扩增和HER2蛋白丰度也更频繁,强调了这些个体的抗HER2治疗。
此外,全面的代谢组学和蛋白质组学分析揭示了铁死亡(ferroptosis)作为基底样肿瘤的潜在治疗靶点。临床、转录组、代谢组、放射组和病理特征的整合使得患者能够高效分层,以应对不同的复发风险。该研究提供了一个公共资源,为亚洲人群乳腺癌的生物学和祖源特异性提供了新的见解,为进一步的精准治疗方法提供了潜在可能性。
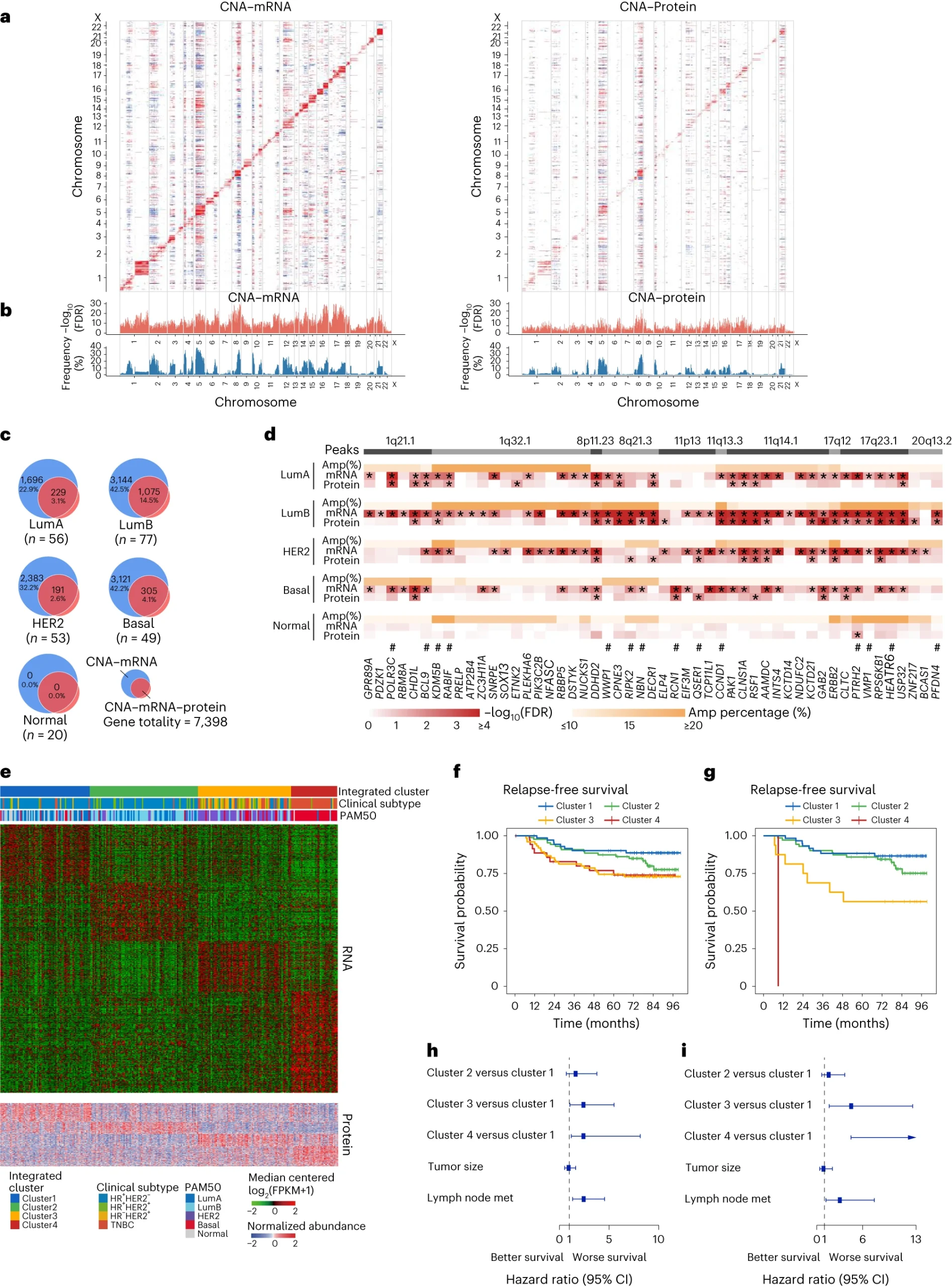
https://www.nature.com/articles/s43018-024-00725-0
5.(Nature Aging,IF:16.6)血浆蛋白质组学特征预测健康成人未来痴呆症

蛋白质组学的发展为预测痴呆症(dementia)发病提供了前所未有的机会。研究人员在英国生物银行(UK Biobank)的52,645名无痴呆症的成年人中进行了研究,其中包括1,417例新发病例,随访时间为14.1年。
在1,463种血浆蛋白中,GFAP、NEFL、GDF15和LTBP2与新发全因痴呆症(ACD)、阿尔茨海默病(AD)和血管性痴呆(VaD)最一致相关,并在蛋白质重要性排序中排名较高。将GFAP(或GDF15)与人口统计学数据结合起来,可以得到对ACD(AUC=0.891)和AD(AUC=0.872)(或VaD(AUC=0.912))的理想预测。即使在预测10年后的ACD、AD和VaD时,情况也是如此。
GFAP水平较高的个体发展为痴呆的可能性是普通人的2.32倍。值得注意的是,GFAP和LTBP2对于痴呆症的预测具有很高的特异性。GFAP和NEFL至少在痴呆症诊断前10年开始发生变化。这些发现强调了GFAP作为痴呆症预测的最佳生物标志物,甚至在诊断之前超过10年,并对于筛查高风险痴呆症患者和早期干预具有重要意义。
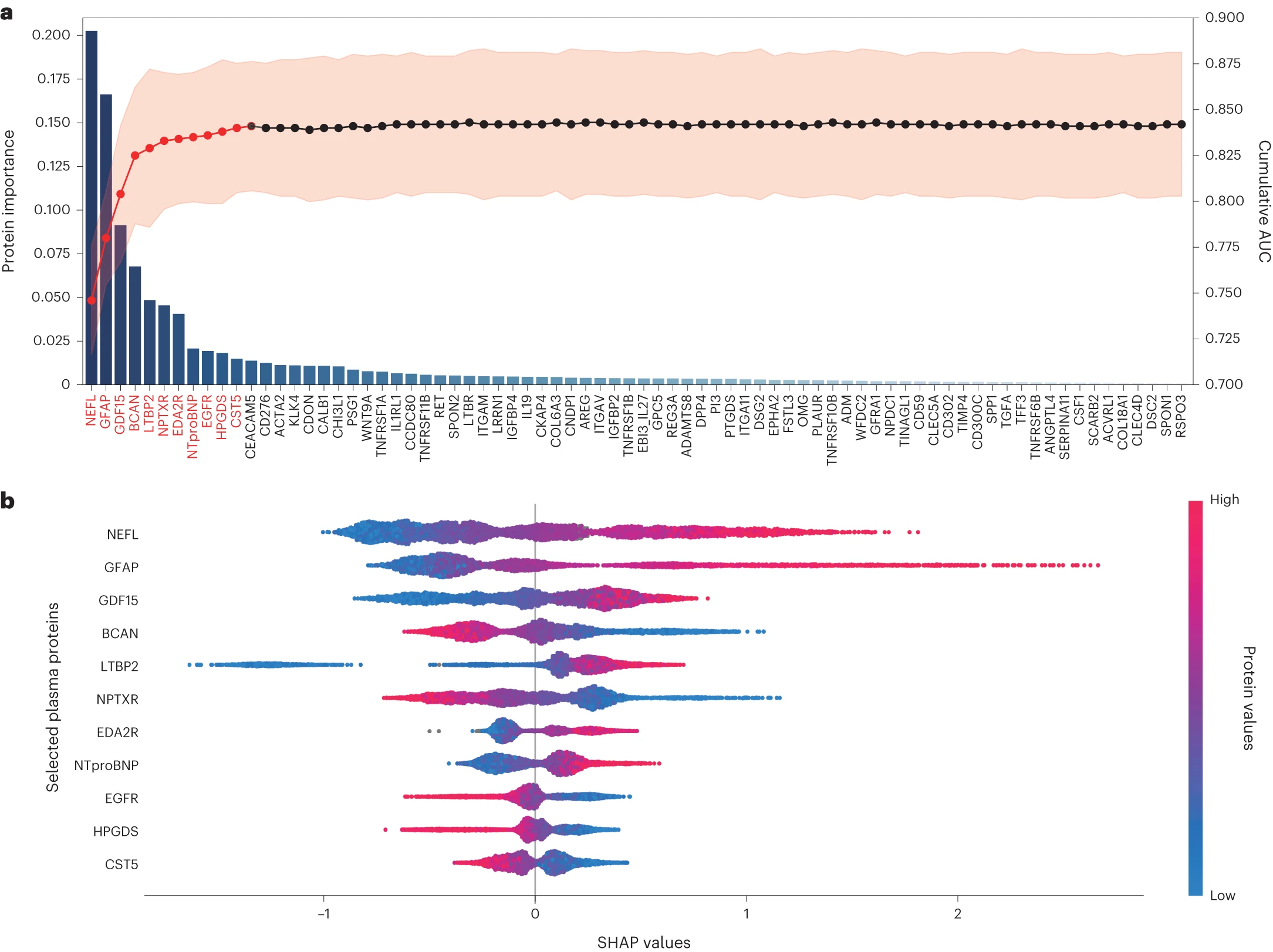
https://www.nature.com/articles/s43587-023-00565-0
6.(Acta Neuropathol,IF: 15.87)阿尔茨海默病和癫痫中相似的脑蛋白质组学特征

癫痫的患病率在阿尔茨海默病(AD)患者中增加,并且认知障碍在癫痫患者中很常见。癫痫和AD存在联系,但共享的病理生理变化尚未明确定义。该研究旨在利用已发表的蛋白质组学数据集识别与癫痫和AD相关的蛋白质差异。
研究人员观察到在癫痫和AD中蛋白质差异存在高度显著的重叠:在癫痫患者海马区发生变化的蛋白质中,有89%(689/777)在AD晚期患者中也发生了显著变化。在癫痫和AD中发生变化的蛋白质中,有340种蛋白质变化方向相同,而216种蛋白质变化方向相反。突触和线粒体蛋白在癫痫和AD中明显减少,表明存在共同的疾病机制。相反,核糖体蛋白在癫痫中增加但在AD中减少。
值得注意的是,许多在癫痫中发生变化的蛋白质与tau蛋白相互作用或受tau表达调控。这表明tau蛋白可能在癫痫和AD中介导共同的蛋白质变化。Aβ和多个磷酸化tau种类(pTau396/404、pTau217、pTau231)的免疫组织化学显示,癫痫海马区节内pTau217和pTau231呈增加趋势,但没有磷酸化tau聚集体或淀粉样斑块。这些结果揭示了癫痫和AD中共同机制的见解,并突显了tau在介导癫痫和AD中共同病理蛋白质变化中的潜在作用。
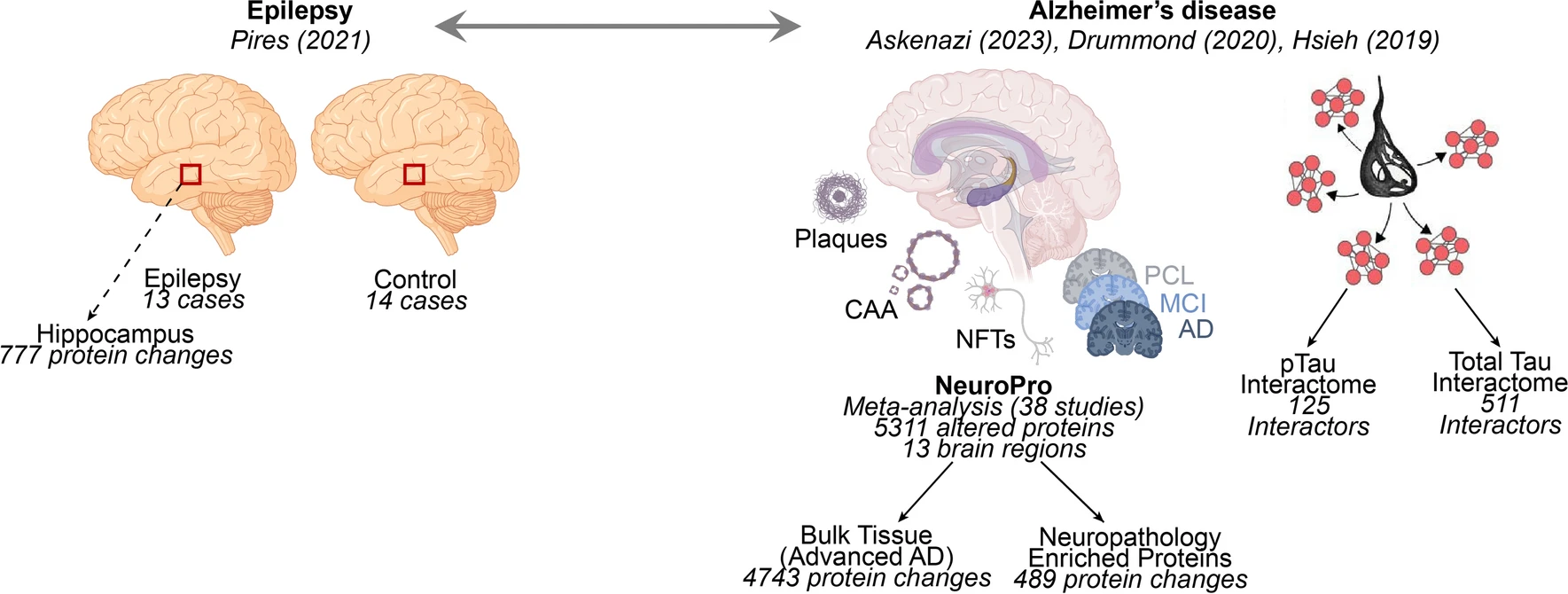
https://link.springer.com/article/10.1007/s00401-024-02683-4
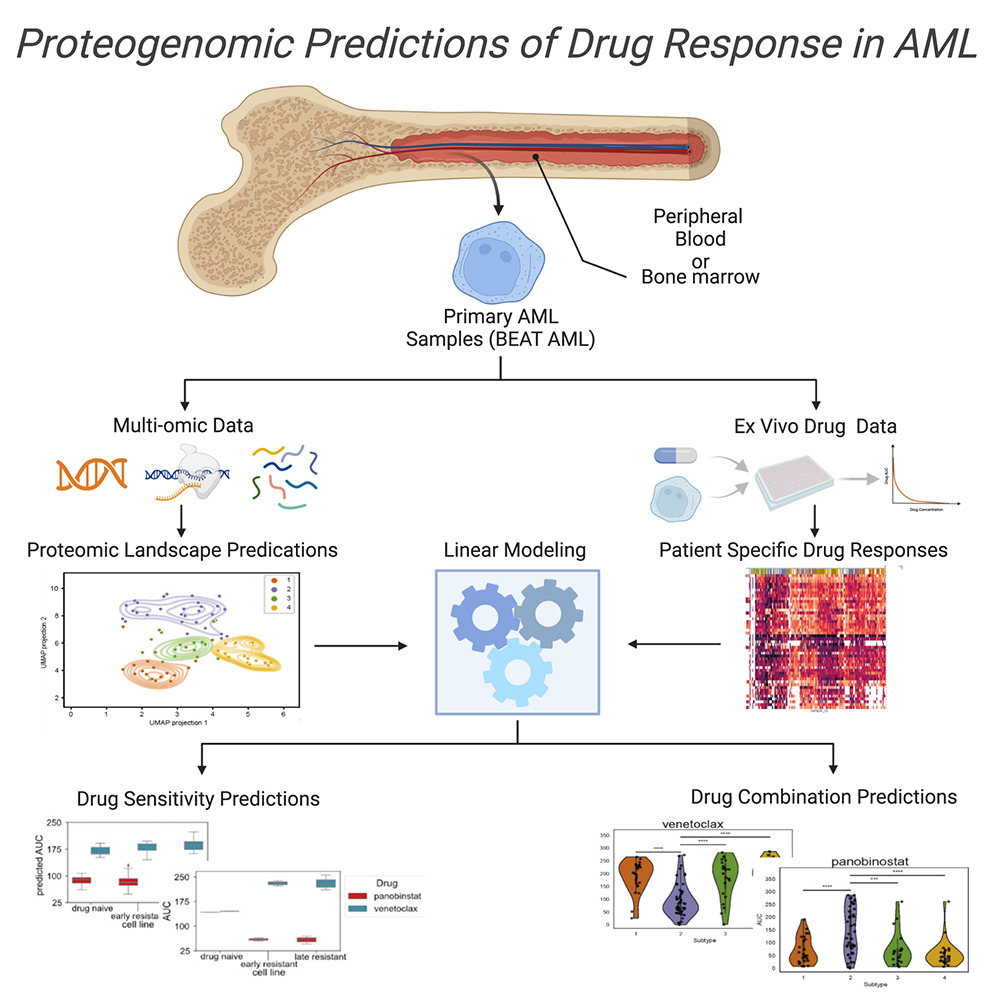
7.(Cell Rep Med,IF: 14.3)绘制蛋白质基因组图谱以预测急性髓细胞白血病的药物反应

急性髓细胞白血病(Acute myeloid leukemia,AML)是一种预后不良的癌症,通常因基因畸变而分层,但这些突变往往是异质的,无法一致地预测治疗反应。研究人员将转录组学、蛋白质组学和磷酸蛋白组学数据与体外药物敏感性数据相结合,以帮助理解AML突变之外的基础病理生理学。
研究人员测量了210名患者的蛋白质组和磷酸化蛋白组,并将其与基因组和转录组测量结合起来,以确定补充现有遗传亚型的四种蛋白质组亚型。他们构建了一个预测器来将样本分类为亚型,并将其映射到识别特定药物反应模式的 “景观” 中。然后,他们构建了一个药物反应预测模型,以识别针对不同亚型的药物,并验证了他们对代表quizartinib(奎扎替尼)耐药不同阶段的细胞系的发现。这些结果显示,多组学数据与药物敏感性数据结合可以为AML中的治疗分层和药物组合提供信息。
https://www.nature.com/articles/s41589-023-01536-7
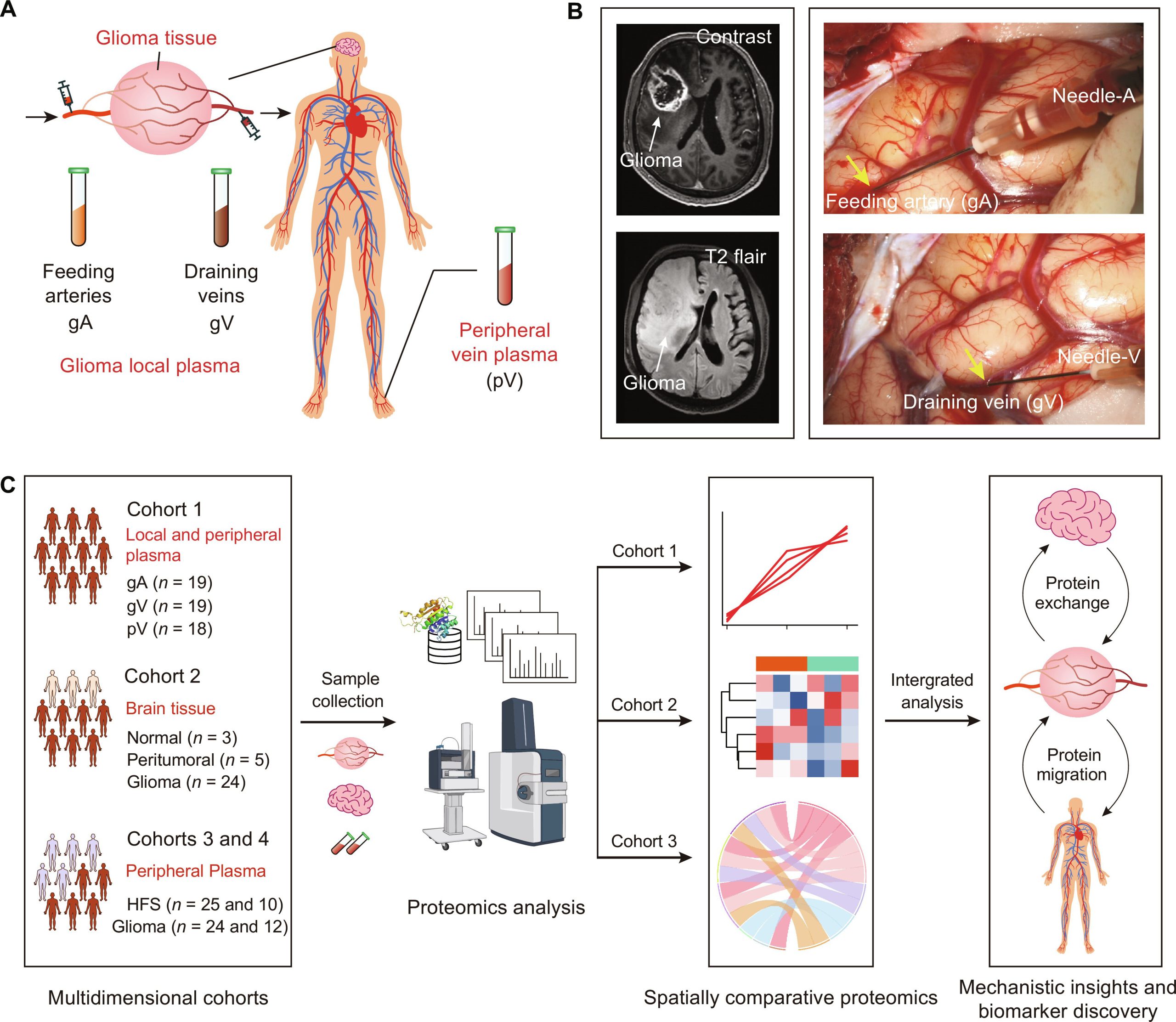
8.(Sci Adv,IF: 13.6)通过空间多维蛋白质组学揭示胶质瘤机制

在分子水平上表征肿瘤微环境对于理解肿瘤发生和演变的机制至关重要。然而,血液蛋白质组在肿瘤局部区域的特异性及其与其他系统的联系很难研究。
研究人员提出了一种以胶质瘤为例的空间多维比较蛋白质组学策略。通过就地收集脑胶质瘤区域的动脉和静脉血液,与外周血进行比较,特异性地确定了肿瘤微环境的血液蛋白质组特征。此外,通过整合不同维度的组织和外周血蛋白质组学,研究揭示了胶质瘤相关蛋白质的产生、迁移和交换信息,为肿瘤机制研究和生物标志物发现提供了强大的方法。该研究招募了多维临床队列,使蛋白质组学结果相互印证,可靠地揭示了特定于胶质瘤的生物学过程,并识别了高度准确的生物标志物。
https://www.pnas.org/doi/10.1073/pnas.2312676121









