1月30日,JAMA 发表了一篇题为 Molecular Phenotyping With Proteomics 的 Insights(见解)文章。文章围绕蛋白质组学在分子表型分析中的应用展开,重点介绍了蛋白质组学在疾病研究、临床诊断和治疗中的潜力。

图1 JAMA 文章截图
分子表型分析与蛋白质组学
蛋白质组(Proteome)指的是生物体系中所有蛋白质的整体,而蛋白质组学(Proteomics)则致力于研究这些蛋白质的组成、功能及相互作用。
现代蛋白质组学技术可以从人体组织样本中鉴定和定量超过 10,000 种蛋白质,为研究疾病机制、药物疗效及基因变异的功能影响提供了新的工具。
蛋白质组学的技术原理
文章指出,质谱分析是蛋白质组学的重要技术(mass spectrometry is the most common technique used to measure many proteins in complex biological samples),其基本流程包括:
♦ 蛋白酶酶解 —— 先用胰蛋白酶等酶类将蛋白质降解为短肽;
♦ 离子化与碎裂 —— 短肽被电离后进一步裂解,生成具有不同质量-电荷比(m/z)的离子;
♦ 数据解析 —— 利用质谱仪记录离子信息,并通过计算机分析推测蛋白质的序列与丰度。
目前的质谱技术已实现超高通量检测,每分钟可获取数千个蛋白质的质谱数据,并可在极少量的样本(如25微克蛋白质,相当于粗针穿刺活检样本10%的量)中定量超过10,000种蛋白。
此外,近年来发展出一种结合DNA条形码抗体或核酸适配体(Aptamer)的技术,利用DNA微阵列(DNA microarray)或 DNA测序(DNA sequencing)手段对蛋白质进行定量,这种方法为非质谱检测提供了新选择。
蛋白质组学的临床应用
早期,蛋白质的临床检测主要依赖抗体等亲和试剂,通过免疫组织化学(IHC)或免疫测定(Immunoassay)方法识别并定量少数几种蛋白。然而,这些方法往往存在重复性差、标准化不足等问题。
近年来,基于质谱的蛋白检测方法逐步成熟,并已获得美国FDA批准用于部分疾病的诊断。
例如,卵巢癌的检测中采用了一种基于血浆蛋白CA 125、前白蛋白、载脂蛋白AI、β2微球蛋白和转铁蛋白的多标志物检测方法,相较于传统抗体检测,提高了检测的可靠性和准确性。
在更广泛的研究领域,蛋白质组学不仅用于单个蛋白的检测,还可进行整体蛋白质组的深入解析。例如,美国国家癌症研究所(NCI)主导的临床蛋白质组肿瘤分析联盟(CPTAC),已对19种癌症类型的3000余例肿瘤及正常组织样本进行了蛋白质组分析。这些研究不仅揭示了癌症发生发展的分子机制,还帮助科学家理解基因突变如何影响蛋白水平,例如KEAP1基因突变如何降低蛋白丰度但不影响 mRNA 转录水平。
CPTAC的研究还推动了蛋白质组学在癌症分型中的应用,例如通过蛋白质组数据对癌症亚型进行重新分类,从而为个性化治疗提供依据。
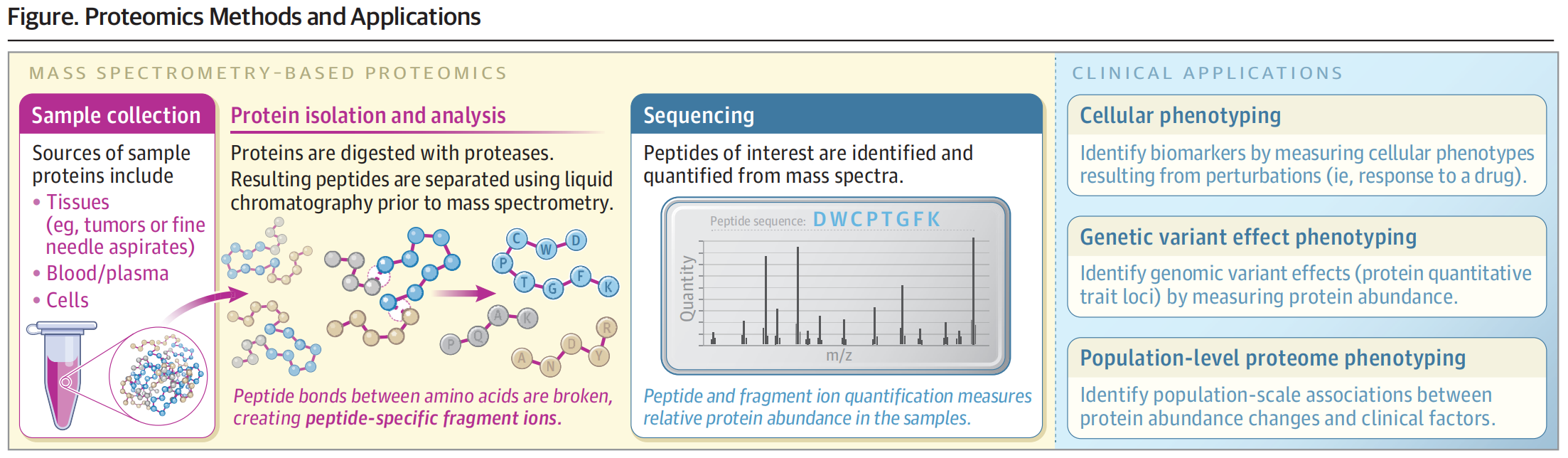
图2 蛋白质组学方法及应用
蛋白质基因组学(Proteogenomics)
蛋白质组学与基因组学(Genomics)及转录组学(Transcriptomics)结合,能揭示基因变异对蛋白质功能的影响。例如,研究发现某些基因位点的遗传变异(蛋白质数量性状位点,pQTL)可以影响蛋白质的表达水平。例如:
♦ CCT6A 基因变异不仅影响自身的蛋白丰度,还会影响整个CCT伴侣蛋白复合体8个成员的表达;
♦ CHRDL2 基因变异与结直肠癌风险降低相关;
♦ TET2 基因变异会影响血浆中与急性髓系白血病相关的FLT3蛋白水平。
虽然非质谱检测方法(如抗体或适配体技术)也能实现大规模蛋白分析,例如在49,736例样本中定量2923种血浆蛋白,但不同检测平台之间的结果一致性仍有待提高。
临床应用的挑战与展望
尽管蛋白质组学在疾病生物标志物的发现、预后评估及治疗响应预测方面展现出潜力,但其临床推广仍面临挑战:
♦ 现有大规模蛋白组检测主要在单个实验室内完成,缺乏标准化流程;
♦ 质谱仪设备昂贵,检测成本高,限制了其大范围使用;
♦ 在空间解析度方面,蛋白质组学仍难以完全替代传统影像技术(如免疫组织化学)。
不过,近年来技术进步已使蛋白质组学在临床应用方面取得突破。例如,术中实时组织分析已成为可能,手术室内的医生可利用质谱仪在1.5秒内分析患者组织,实现快速诊断。
此外,激光显微切割技术结合蛋白质组学,已用于研究Janus激酶(JAK)抑制剂)在治疗中毒性表皮坏死松解症(TEN)中的作用,这些进展显示了蛋白质组学在精准医学中的潜力。
蛋白质组学在临床决策中的证据基础
目前,多蛋白检测panel已被建议用于临床决策,如辅助影像学检查或确定患者是否需要转诊,但相关证据仍然有限。例如:
♦ CA 125相关血清生物标志物panel,在妇科肿瘤转诊中的应用仅获得C级推荐(即证据质量较低,需谨慎使用);
♦ 肝纤维化风险评分(结合3种生物标志物)被推荐用于脂肪肝患者,但同样属于C级推荐。
尽管美国医保(CMS)已将蛋白质组学检测纳入报销范围,但大规模推广仍需更多高质量研究数据支持。
结 论
随着质谱技术和生物信息学工具的不断发展,蛋白质组学的灵敏度和通量将进一步提高,成本也有望降低。大规模、高通量的蛋白质谱分析正成为现实。
同时,蛋白质组学与基因组学、转录组学、代谢组学的结合将成为未来研究的主流方向,从而更全面地揭示疾病的分子机制。
虽然当前仍存在技术成本、标准化和空间解析度等方面的挑战,但蛋白质组学在精准医学中的潜力巨大,未来有望在疾病诊断、治疗决策及生物标志物发现方面发挥重要作用。








