上月,“女版乔布斯”、血液检测公司Theranos创始人伊丽莎白·霍尔姆斯(Elizabeth Holmes)正式入狱,开始了长达11年的牢狱生涯。
Theranos曾号称可以通过指尖的数滴血快速检测癌症、糖尿病等十几种疾病,后被媒体曝光 “滴血验癌” 骗局。

图1 号称可“滴血验癌”的Theranos创始人Elizabeth Holmes 图源:wikipedia.org
几滴血,测癌症,是科学骗局还是未来可期?
这个问题,体液蛋白质组学或许能给出回答。
♦ 神奇的体液蛋白质组学
人类基因组序列草图完成后,生命科学进入 “后基因组时代”,研究重点转向了蛋白质。作为生命活动的主要承担者,蛋白质是细胞功能的执行分子,同时也是绝大多数药物的作用靶点 [1]。
研究者很早就发现,在许多生理或病理状态下,机体分泌的一些关键调节蛋白或应激蛋白在体液中会有量或质的变化。例如,神经系统病变会在脑脊液中产生Tau蛋白、β-淀粉样蛋白、前体蛋白、载脂蛋白D等 [2]。
人体的体液主要有血浆/血清、尿液、脑脊液、唾液、支气管肺泡分泌液、关节滑液、乳腺导管抽吸液、泪液、羊水等。体液中的蛋白质信息,对疾病的筛选、早期诊断、病情监测、预后评价、药物作用靶点筛选、药物效应分析及药物毒性评估等都具有重要的价值。
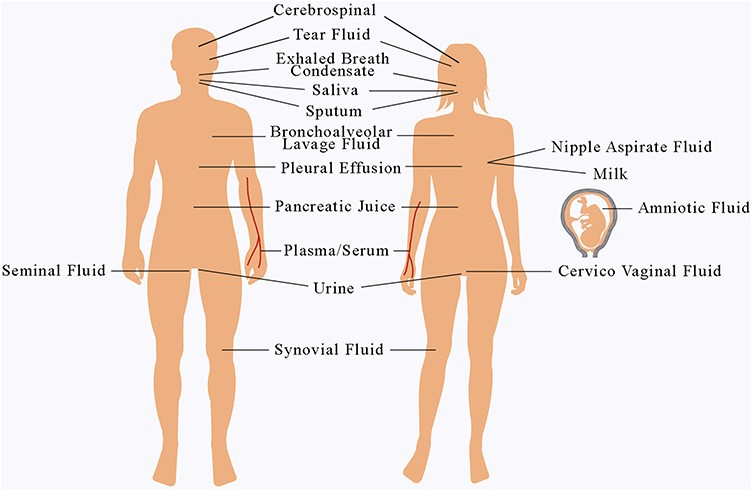
图2 人体16种主要体液 图源[3]
体液蛋白质组学(human body fluid proteomics,HBFP),即用蛋白质组学研究方法,对机体体液在蛋白质水平上进行全面分析,以获得相应的生物标志物及药物作用靶点,为诊疗和药物研发等领域提供重要线索。
在体液蛋白质组学中,最常用的研究对象是血液(血浆/血清)和尿液。
◊ 血 液
人体血液中含有大量重要的蛋白质、核酸和代谢物,可用作疾病的临床诊断和治疗工具。有学者预测,临床血液蛋白质组学必将成为血液学下个十年的研究焦点之一。[4]
2020年5月,西湖大学蛋白质组大数据实验室及合作者在Cell上发表血液蛋白质组研究成果。通过对新冠感染者血液中的蛋白质和代谢物分子的系统检测,发现重症患者的血清中存在多种独特的分子变化,并找到了一系列生物标志物,预测新冠感染患者轻、重症,为临床提前干预提供指导。[5]

图3 论文截图 图源[5]
在癌症研究中,血液也是寻找潜在生物标志物的常用标本。
例如,2020年,西湖大学蛋白质组大数据实验室和合作者发现了肠癌患者血浆中的蛋白标志物,找到了治疗大肠癌的潜在新靶点 [6]。如今,体液蛋白质组技术也确实越来越多地应用于临床生物标志物的发现,目前,研究人员已经发现了大量与肺癌等癌症相关的血液蛋白质组变化信息。
据WHO统计, 人类疾病的种类超过14500种, 然而被FDA批准用于临床使用的来源于血浆/血清的蛋白质生物标记物目前不足200个 [4],这仍算是一块亟待探索与验证的领域。
血液样本的蛋白质组学分析也存在一定的缺点。例如,侵入性的采样方式不够便捷、现有技术对血液超低丰度蛋白质的定量能力较差。另外,血液受到人体内稳态机制的调节,当人体发生变化(尤其是变化较轻较早)时,可能很难发现血液中各类蛋白质分子组成的改变。[7]
◊ 尿 液
相比血液,尿液收集全身代谢废物,变化比血液更加丰富;尿液采集简单、无创,且尿液中高丰度蛋白含量相对血液的高丰度含量占比要低得多,这更利于低丰度蛋白的鉴定。
尿液中携带的大量信息,能反映肾脏和泌尿系统及身体其他器官的生理或病理变化,这使得尿液成为疾病诊断、监测和预后判断生物标志物的重要来源。[8]
上世纪70年代末,有学者大胆预言,只要检测方法足够灵敏,正常血浆中的所有蛋白都可以在尿液中检测到 [9]。如今,研究者已经证明,尿液中的蛋白分子量分布与全人类蛋白组的蛋白分子量分布一致 [7]。
随着蛋白质组学检测技术的不断进步和尿液中微量蛋白检测灵敏度及稳定性的不断提高,近年来,尿蛋白质组学在各类肿瘤生物标志物发现的研究中得到迅速发展。如:泌尿系统肿瘤(膀胱癌、肾癌、前列腺癌等)、呼吸系统肿瘤(肺癌)、乳腺及妇科肿瘤(乳腺癌、卵巢癌、子宫内膜癌等)、消化系统肿瘤(肝癌、结直肠癌、胰腺癌、胃癌等)。[7]
随着蛋白质组学技术的不断进步,越来越多的疾病在尿液蛋白组学层面得到了广泛的研究。
2021年,西湖大学蛋白质组大数据实验室与合作团队在 Cell Reports 发表体液(尿液)蛋白质组学研究成果:从尿液中筛选出20个蛋白质标志物并建立模型,成功实现了对轻、重型新冠肺炎患者的分类预测,同时有针对性地提出了新冠肺炎患者存在潜在肾损伤的证据。该研究表明,从新冠肺炎患者尿液中获取的蛋白质分子变化信息可以灵敏地反映机体的病理状态。[10]

图4 论文截图 图源[10]
但现存的尿液蛋白组研究也存在许多问题。例如,在肿瘤标志物研究中,多数尿蛋白标志物的研究还不够成熟,大部分蛋白质组学研究均处于单中心研究阶段,且缺乏在其他肿瘤患者尿液中的验证研究,无法评价其诊断肿瘤的特异性。
因此,尿液蛋白质组学需要扩大临床验证组的样本量、促进临床多中心合作和提高候选标志物在其他肿瘤中的验证研究。另外,由于尿液是实时由机体产生的,样本异质性较高,因此如何在较高的异质性中发现普适性的规律或者降低尿液的异质性,依然是尿液蛋白组学研究领域亟待解决的问题。
除了血液和尿液,非侵入性采集的唾液、汗液等体液也备受研究者关注。如唾液蛋白在口腔癌、肺癌等多种癌症中的应用,汗液中的囊性纤维化跨膜传导调节蛋白在囊性纤维化中的应用等。[7]
随着蛋白质组学技术的飞速发展,特别是高通量和超灵敏的深度蛋白质组学技术及单细胞蛋白质组学技术的日益成熟,研究者已经成功地在各种体液中鉴定出大量蛋白质,并在揭示体液蛋白质组方面取得了较大进展。截至2020年,科学家们已经在人体主要体液中发现了超过15000种不同的蛋白质 [3],这个数字还在不断上涨。
也就是说,Theranos公司曾号称的利用血液检测癌症等疾病,在蛋白质组学的世界里,并非是遥不可及的未来。
♦ 一管血?一滴血?
仅靠数滴或一滴血,真的可以给到我们丰富、系统的人体健康信息吗?
一般情况下,去医院进行甲状腺功能、肝功能等项目检查,需要抽取1试管(约5ml)静脉血;对于部分需要输血治疗的患者,由于要进行血型、凝血功能及血常规等多项检查,可能需要抽取多试管(约30ml)血液。即使是最简单的血常规或传染病检查(如乙肝、梅毒等),也至少要抽3-5ml。
微量蛋白质组学技术的发展,可以很好解决样品量少和分析难度大、成本高等问题,实现了临床样本 “少一点” “更少一点” “再少一点” 的目标。微量体液蛋白质组检测技术,可以在极低的样本量下实现高丰度蛋白和低丰度蛋白的深度覆盖检测。
最新的超灵敏蛋白质组学技术,已经可以实现对纳克(0.001微克)级微量样本的深度分析 [4],可以从比芝麻还小的组织或一滴血的1/10中快速、高通量地鉴定出数千个蛋白质,为我们理解疾病提供大量信息。
2022年底,斯坦福大学的研究团队建立了一种微量取血并从其中采集多组学数据的平台,可从微量血样(10μL)中采集到包括蛋白质组在内的多组学数据。受试者可以自己在家采集微量血样,并通过快递将其寄送到实验室进行多组学数据的采集和分析。该研究证明了微量取血多组学数据确实可以反应人体在进食之后的快速的代谢变化,以及定量监测不同个体对不同营养物质的反应能力,并具有生物标志物发现、个性化健康监测、治疗药物监测等潜在应用。[11]
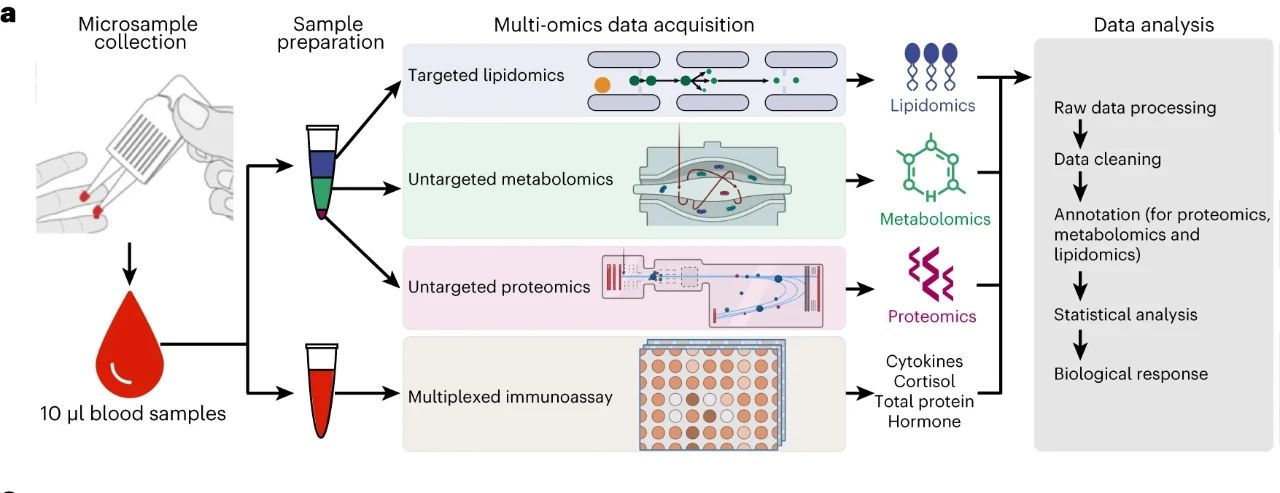
图5 使用微量采集装置取血,然后获取多组学数据(蛋白质组、代谢组、细胞因子和荷尔蒙数据等)图源[11]
这些基于微量临床样本的技术和研究,让我们得以隐隐窥见 “滴血验癌” 的曙光。
♦ 道阻且跻,行则将至
新的高通量和自动化的蛋白质分离、鉴定技术平台相继出现并迅速普及,对液体蛋白质组学的分析产生了积极影响。
十几年前,人血浆中只能确切检测到数百个蛋白质,如今已经可以检测数千个,还发现了许多低丰度蛋白,大大拓展了血浆等体液蛋白质组学研究的深度和广度。全球的研究者对各种体液的蛋白质组都初步建立了其表达谱或者肽指纹图谱,对常见的疾病蛋白质标记物的研究也作了重要的探索性研究。[12]
近几年,随着蛋白质组学技术的进步,研究人员一个小时就能测出8000~10000个蛋白质,可以在肿瘤组织等临床样品中得到非常多的蛋白质数据。而这项工作的成本也很低:2020年用质谱测一个蛋白质就已经只需0.1美金了,现在只会更低。
不过,体液蛋白质组学研究仍存在许多瓶颈。
技术方面,主要是检测深度和通量上的缺陷。首先是对于样本中蛋白质的筛查深度不足,这是限制质谱技术在体液中发现新的疾病标志物的主要瓶颈之一。以血浆为例,约占血浆蛋白质种类总数95%以上的蛋白质仍没法被当前绝大多数的筛查技术检测到。
其次是实验方法的通量不够。由于临床体液样本的个体差异较大,生物标志物的研究通常需要分析数百个临床样本。因此,需要不断提高临床样本的分析通量。
而这些瓶颈,也是绝大多数体液蛋白质组学技术成果未能实现临床转化的主要原因。
此外,目前科学界既有的一些小规模和特定的体液蛋白质组数据资源,无法支撑更为系统和更大样本量的研究。体液蛋白质组学的进一步发展,也需要世界各国研究者在体液蛋白数据的储存和分享上通力合作,以期形成系统的数据库和分析工具。
未来,体液蛋白质组学研究需要蛋白质组学技术的不断发展,尤其是微量、高通量技术的更新, 并与基因组、转录组和代谢组等多组学相结合以指导基础研究、临床应用和治疗创新, 从而实现对疾病的精准临床诊疗。在备受关注的生物标志物研究领域,还需要政策和伦理的支持、资金和人力长期持续的投入以及大样本、大数据的支撑。
我们希望,随着各种研究方法及技术平台的更新,体液蛋白质组学研究将会取得系列突破性进展,为无数疾病患者带来诊治的新希望。
“滴血验病” “滴血验癌”,并非科学骗局,实则未来可期。

“滴血验病” “滴血验癌”,未来可期 图源:pexels.com
⇒ 补充资料:
体液蛋白质组学数据库
2001年10月,国际人类蛋白质组组织(Human Proteome Organization,HUPO)成立,并计划启动人类蛋白质组计划(HumanProteome Project,HPP)。次年,HUPO启动人类血浆蛋白组计划(Human Plasma Proteome Project,HUPO PPP),并在其在线数据库中报告了人类血浆和血清蛋白质成分。目前,HUPO PPP由来自世界十多个国家和地区的50多个实验室参加,全面鉴定和分析正常人血浆/血清蛋白质组。[13]
自2002年起,体液蛋白质组的研究已经进行了20余年,并建立了一些体液蛋白质组数据库,例如:
2014年,血浆蛋白质组数据库(Plasma Proteome Database)储存了在人类血液中检测到的1万多个蛋白质;[14]
2010年的蛋白质组学鉴定数据库(Proteomics Identifications database)及2017年的人类血浆肽图谱(Human Plasma PeptideAtlas)共报告了3500余种高置信度血浆蛋白。[15,16]
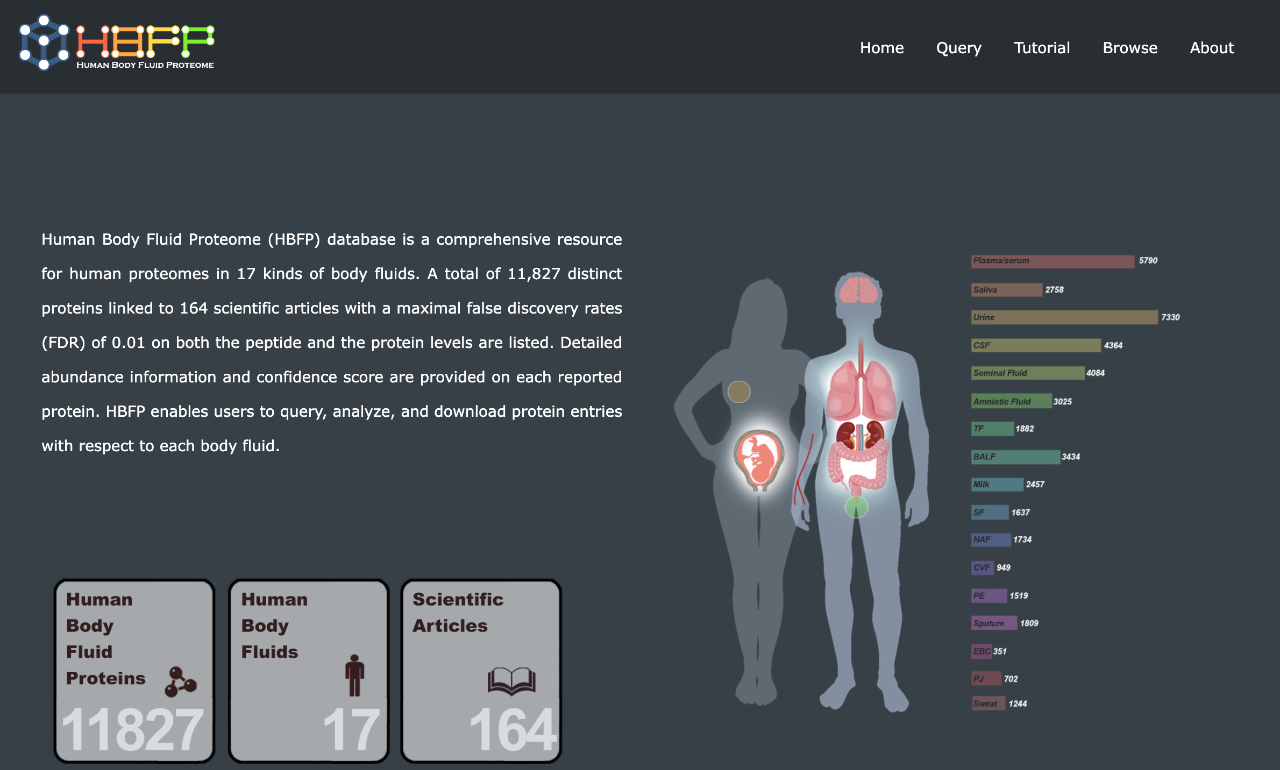
人体体液蛋白质组数据库(HBFP)网站 图源[18]
参考文献:
西湖欧米自成立以来,承接了诸多临床血液蛋白质组项目。目前,实测4个batch TMT检测总蛋白鉴定量高至2900+,单Batch蛋白鉴定量平均能达2500+。经团队潜心研发,现正式推出OmniProt深度血液蛋白质组服务,蛋白检出率显著提升!
团队采用特色化学微粒式富集血液中的中低丰度蛋白,高深度TMT方法进行上机检测,目前,TMT单Batch蛋白鉴定量平均能达2500+,实测4个batch TMT检测总蛋白鉴定量高至2900+。当血液中蛋白含量增加时,我们发现OmniProt带来的中低丰度蛋白含量占比>95%以上。因此,我们可从中发现更多的差异蛋白。
上月,“女版乔布斯”、血液检测公司Theranos创始人伊丽莎白·霍尔姆斯(Elizabeth Holmes)正式入狱,开始了长达11年的牢狱生涯。
Theranos曾号称可以通过指尖的数滴血快速检测癌症、糖尿病等十几种疾病,后被媒体曝光 “滴血验癌” 骗局。

图1 号称可“滴血验癌”的Theranos创始人Elizabeth Holmes 图源:wikipedia.org
几滴血,测癌症,是科学骗局还是未来可期?
这个问题,体液蛋白质组学或许能给出回答。
♦ 神奇的体液蛋白质组学
人类基因组序列草图完成后,生命科学进入 “后基因组时代”,研究重点转向了蛋白质。作为生命活动的主要承担者,蛋白质是细胞功能的执行分子,同时也是绝大多数药物的作用靶点 [1]。
研究者很早就发现,在许多生理或病理状态下,机体分泌的一些关键调节蛋白或应激蛋白在体液中会有量或质的变化。例如,神经系统病变会在脑脊液中产生Tau蛋白、β-淀粉样蛋白、前体蛋白、载脂蛋白D等 [2]。
人体的体液主要有血浆/血清、尿液、脑脊液、唾液、支气管肺泡分泌液、关节滑液、乳腺导管抽吸液、泪液、羊水等。体液中的蛋白质信息,对疾病的筛选、早期诊断、病情监测、预后评价、药物作用靶点筛选、药物效应分析及药物毒性评估等都具有重要的价值。

图2 人体16种主要体液 图源[3]
体液蛋白质组学(human body fluid proteomics,HBFP),即用蛋白质组学研究方法,对机体体液在蛋白质水平上进行全面分析,以获得相应的生物标志物及药物作用靶点,为诊疗和药物研发等领域提供重要线索。
在体液蛋白质组学中,最常用的研究对象是血液(血浆/血清)和尿液。
◊ 血 液
人体血液中含有大量重要的蛋白质、核酸和代谢物,可用作疾病的临床诊断和治疗工具。有学者预测,临床血液蛋白质组学必将成为血液学下个十年的研究焦点之一。[4]
2020年5月,西湖大学蛋白质组大数据实验室及合作者在Cell上发表血液蛋白质组研究成果。通过对新冠感染者血液中的蛋白质和代谢物分子的系统检测,发现重症患者的血清中存在多种独特的分子变化,并找到了一系列生物标志物,预测新冠感染患者轻、重症,为临床提前干预提供指导。[5]

图3 论文截图 图源[5]
在癌症研究中,血液也是寻找潜在生物标志物的常用标本。
例如,2020年,西湖大学蛋白质组大数据实验室和合作者发现了肠癌患者血浆中的蛋白标志物,找到了治疗大肠癌的潜在新靶点 [6]。如今,体液蛋白质组技术也确实越来越多地应用于临床生物标志物的发现,目前,研究人员已经发现了大量与肺癌等癌症相关的血液蛋白质组变化信息。
据WHO统计, 人类疾病的种类超过14500种, 然而被FDA批准用于临床使用的来源于血浆/血清的蛋白质生物标记物目前不足200个 [4],这仍算是一块亟待探索与验证的领域。
血液样本的蛋白质组学分析也存在一定的缺点。例如,侵入性的采样方式不够便捷、现有技术对血液超低丰度蛋白质的定量能力较差。另外,血液受到人体内稳态机制的调节,当人体发生变化(尤其是变化较轻较早)时,可能很难发现血液中各类蛋白质分子组成的改变。[7]
◊ 尿 液
相比血液,尿液收集全身代谢废物,变化比血液更加丰富;尿液采集简单、无创,且尿液中高丰度蛋白含量相对血液的高丰度含量占比要低得多,这更利于低丰度蛋白的鉴定。
尿液中携带的大量信息,能反映肾脏和泌尿系统及身体其他器官的生理或病理变化,这使得尿液成为疾病诊断、监测和预后判断生物标志物的重要来源。[8]
上世纪70年代末,有学者大胆预言,只要检测方法足够灵敏,正常血浆中的所有蛋白都可以在尿液中检测到 [9]。如今,研究者已经证明,尿液中的蛋白分子量分布与全人类蛋白组的蛋白分子量分布一致 [7]。
随着蛋白质组学检测技术的不断进步和尿液中微量蛋白检测灵敏度及稳定性的不断提高,近年来,尿蛋白质组学在各类肿瘤生物标志物发现的研究中得到迅速发展。如:泌尿系统肿瘤(膀胱癌、肾癌、前列腺癌等)、呼吸系统肿瘤(肺癌)、乳腺及妇科肿瘤(乳腺癌、卵巢癌、子宫内膜癌等)、消化系统肿瘤(肝癌、结直肠癌、胰腺癌、胃癌等)。[7]
随着蛋白质组学技术的不断进步,越来越多的疾病在尿液蛋白组学层面得到了广泛的研究。
2021年,西湖大学蛋白质组大数据实验室与合作团队在 Cell Reports 发表体液(尿液)蛋白质组学研究成果:从尿液中筛选出20个蛋白质标志物并建立模型,成功实现了对轻、重型新冠肺炎患者的分类预测,同时有针对性地提出了新冠肺炎患者存在潜在肾损伤的证据。该研究表明,从新冠肺炎患者尿液中获取的蛋白质分子变化信息可以灵敏地反映机体的病理状态。[10]

图4 论文截图 图源[10]
但现存的尿液蛋白组研究也存在许多问题。例如,在肿瘤标志物研究中,多数尿蛋白标志物的研究还不够成熟,大部分蛋白质组学研究均处于单中心研究阶段,且缺乏在其他肿瘤患者尿液中的验证研究,无法评价其诊断肿瘤的特异性。
因此,尿液蛋白质组学需要扩大临床验证组的样本量、促进临床多中心合作和提高候选标志物在其他肿瘤中的验证研究。另外,由于尿液是实时由机体产生的,样本异质性较高,因此如何在较高的异质性中发现普适性的规律或者降低尿液的异质性,依然是尿液蛋白组学研究领域亟待解决的问题。
除了血液和尿液,非侵入性采集的唾液、汗液等体液也备受研究者关注。如唾液蛋白在口腔癌、肺癌等多种癌症中的应用,汗液中的囊性纤维化跨膜传导调节蛋白在囊性纤维化中的应用等。[7]
随着蛋白质组学技术的飞速发展,特别是高通量和超灵敏的深度蛋白质组学技术及单细胞蛋白质组学技术的日益成熟,研究者已经成功地在各种体液中鉴定出大量蛋白质,并在揭示体液蛋白质组方面取得了较大进展。截至2020年,科学家们已经在人体主要体液中发现了超过15000种不同的蛋白质 [3],这个数字还在不断上涨。
也就是说,Theranos公司曾号称的利用血液检测癌症等疾病,在蛋白质组学的世界里,并非是遥不可及的未来。
♦ 一管血?一滴血?
仅靠数滴或一滴血,真的可以给到我们丰富、系统的人体健康信息吗?
一般情况下,去医院进行甲状腺功能、肝功能等项目检查,需要抽取1试管(约5ml)静脉血;对于部分需要输血治疗的患者,由于要进行血型、凝血功能及血常规等多项检查,可能需要抽取多试管(约30ml)血液。即使是最简单的血常规或传染病检查(如乙肝、梅毒等),也至少要抽3-5ml。
微量蛋白质组学技术的发展,可以很好解决样品量少和分析难度大、成本高等问题,实现了临床样本 “少一点” “更少一点” “再少一点” 的目标。微量体液蛋白质组检测技术,可以在极低的样本量下实现高丰度蛋白和低丰度蛋白的深度覆盖检测。
最新的超灵敏蛋白质组学技术,已经可以实现对纳克(0.001微克)级微量样本的深度分析 [4],可以从比芝麻还小的组织或一滴血的1/10中快速、高通量地鉴定出数千个蛋白质,为我们理解疾病提供大量信息。
2022年底,斯坦福大学的研究团队建立了一种微量取血并从其中采集多组学数据的平台,可从微量血样(10μL)中采集到包括蛋白质组在内的多组学数据。受试者可以自己在家采集微量血样,并通过快递将其寄送到实验室进行多组学数据的采集和分析。该研究证明了微量取血多组学数据确实可以反应人体在进食之后的快速的代谢变化,以及定量监测不同个体对不同营养物质的反应能力,并具有生物标志物发现、个性化健康监测、治疗药物监测等潜在应用。[11]

图5 使用微量采集装置取血,然后获取多组学数据(蛋白质组、代谢组、细胞因子和荷尔蒙数据等)图源[11]
这些基于微量临床样本的技术和研究,让我们得以隐隐窥见 “滴血验癌” 的曙光。
♦ 道阻且跻,行则将至
新的高通量和自动化的蛋白质分离、鉴定技术平台相继出现并迅速普及,对液体蛋白质组学的分析产生了积极影响。
十几年前,人血浆中只能确切检测到数百个蛋白质,如今已经可以检测数千个,还发现了许多低丰度蛋白,大大拓展了血浆等体液蛋白质组学研究的深度和广度。全球的研究者对各种体液的蛋白质组都初步建立了其表达谱或者肽指纹图谱,对常见的疾病蛋白质标记物的研究也作了重要的探索性研究。[12]
近几年,随着蛋白质组学技术的进步,研究人员一个小时就能测出8000~10000个蛋白质,可以在肿瘤组织等临床样品中得到非常多的蛋白质数据。而这项工作的成本也很低:2020年用质谱测一个蛋白质就已经只需0.1美金了,现在只会更低。
不过,体液蛋白质组学研究仍存在许多瓶颈。
技术方面,主要是检测深度和通量上的缺陷。首先是对于样本中蛋白质的筛查深度不足,这是限制质谱技术在体液中发现新的疾病标志物的主要瓶颈之一。以血浆为例,约占血浆蛋白质种类总数95%以上的蛋白质仍没法被当前绝大多数的筛查技术检测到。
其次是实验方法的通量不够。由于临床体液样本的个体差异较大,生物标志物的研究通常需要分析数百个临床样本。因此,需要不断提高临床样本的分析通量。
而这些瓶颈,也是绝大多数体液蛋白质组学技术成果未能实现临床转化的主要原因。
此外,目前科学界既有的一些小规模和特定的体液蛋白质组数据资源,无法支撑更为系统和更大样本量的研究。体液蛋白质组学的进一步发展,也需要世界各国研究者在体液蛋白数据的储存和分享上通力合作,以期形成系统的数据库和分析工具。
未来,体液蛋白质组学研究需要蛋白质组学技术的不断发展,尤其是微量、高通量技术的更新, 并与基因组、转录组和代谢组等多组学相结合以指导基础研究、临床应用和治疗创新, 从而实现对疾病的精准临床诊疗。在备受关注的生物标志物研究领域,还需要政策和伦理的支持、资金和人力长期持续的投入以及大样本、大数据的支撑。
我们希望,随着各种研究方法及技术平台的更新,体液蛋白质组学研究将会取得系列突破性进展,为无数疾病患者带来诊治的新希望。
“滴血验病” “滴血验癌”,并非科学骗局,实则未来可期。

“滴血验病” “滴血验癌”,未来可期 图源:pexels.com
⇒ 补充资料:
体液蛋白质组学数据库
2001年10月,国际人类蛋白质组组织(Human Proteome Organization,HUPO)成立,并计划启动人类蛋白质组计划(HumanProteome Project,HPP)。次年,HUPO启动人类血浆蛋白组计划(Human Plasma Proteome Project,HUPO PPP),并在其在线数据库中报告了人类血浆和血清蛋白质成分。目前,HUPO PPP由来自世界十多个国家和地区的50多个实验室参加,全面鉴定和分析正常人血浆/血清蛋白质组。[13]
自2002年起,体液蛋白质组的研究已经进行了20余年,并建立了一些体液蛋白质组数据库,例如:
2014年,血浆蛋白质组数据库(Plasma Proteome Database)储存了在人类血液中检测到的1万多个蛋白质;[14]
2010年的蛋白质组学鉴定数据库(Proteomics Identifications database)及2017年的人类血浆肽图谱(Human Plasma PeptideAtlas)共报告了3500余种高置信度血浆蛋白。[15,16]

人体体液蛋白质组数据库(HBFP)网站 图源[18]
参考文献:
西湖欧米自成立以来,承接了诸多临床血液蛋白质组项目。目前,实测4个batch TMT检测总蛋白鉴定量高至2900+,单Batch蛋白鉴定量平均能达2500+。经团队潜心研发,现正式推出OmniProt深度血液蛋白质组服务,蛋白检出率显著提升!
团队采用特色化学微粒式富集血液中的中低丰度蛋白,高深度TMT方法进行上机检测,目前,TMT单Batch蛋白鉴定量平均能达2500+,实测4个batch TMT检测总蛋白鉴定量高至2900+。当血液中蛋白含量增加时,我们发现OmniProt带来的中低丰度蛋白含量占比>95%以上。因此,我们可从中发现更多的差异蛋白。