
文献目录
1 小细胞肺癌蛋白基因组学研究揭示其分子特征及亚型特异性治疗策略
2 单细胞和空间分析鉴定三阴性乳腺癌对Pembrolizumab和放疗的三种响应轨迹
3 “仿生” 肿瘤钙化引导的肝细胞癌早诊与根除
4 胶质母细胞瘤干细胞的小细胞外囊泡的多组学分析
5 胃癌舌苔宏蛋白组分析的多中心诊断研究
6 乘客基因共扩增造成癌症的附带治疗漏洞
7 SnapATAC2:用于分析单细胞组学数据的快速、可扩展多功能工具
8 定量蛋白组学揭示改良安卡拉痘苗病毒感染期间的抗病毒防御和细胞死亡机制
一起来看看本周蛋白组学领域的精选优质文献吧!
1.(Cell,IF:64.5)小细胞肺癌蛋白基因组学研究揭示其分子特征及亚型特异性治疗策略

研究人员利用112名接受手术切除的未经治疗患者的配对肿瘤和邻近肺组织,对小细胞肺癌(SCLC)进行了全面的蛋白质基因组学(proteogenomic)表征。综合多组学分析显示了基因畸变下游的癌症生物学特性,并突出了FAT1突变、RB1缺失和5q染色体缺失的致癌作用。
研究发现了两个预后生物标志物HMGB3和CASP10。HMGB3的过表达通过细胞连接相关基因的转录调控促进了SCLC细胞的迁移。免疫景观表征揭示了ZFHX3突变与高免疫浸润之间的关联,并强调了通过抑制cGAS-STING途径的DNA损伤响应活性提升可能存在的免疫抑制作用。
多组学聚类分析确定了具有亚型特异性治疗弱点的四种亚型。基于细胞系和患者来源异种移植的药物试验验证了多组学亚型预测的特异性治疗反应。这项研究为更好地了解SCLC生物学和改善临床实践提供了宝贵的资源和见解。
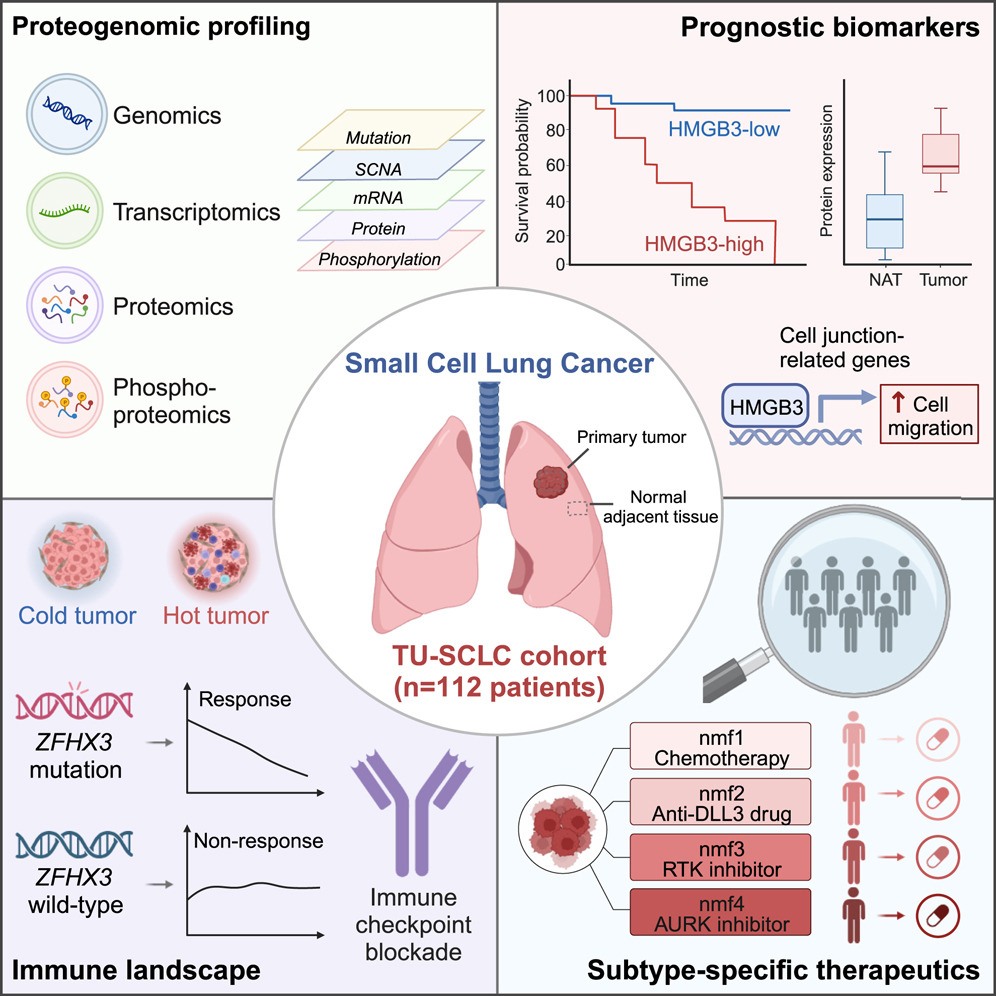
https://doi.org/10.1016/j.cell.2023.12.004
2.(Cancer Cell,IF:50.3)多组学分析鉴定三阴性乳腺癌对派姆单抗和放疗的三种治疗应答轨迹

哪些患者单纯通过免疫疗法就能获益?哪些患者可能需要额外进行化疗或放疗以克服抵抗力?我们需要有更好的治疗策略才能识别他们。
研究人员采用单细胞转录组学和空间蛋白质组学,对基线、派姆单抗(Pembrolizumab)单独治疗一个周期后,以及与放疗一同进行第二个周期派姆单抗治疗后的三阴性乳腺癌活检进行了分析。无应答者在治疗前后缺乏免疫浸润,并且表现出最小的治疗引起的免疫变化。有应答的肿瘤形成了两个组,可以在治疗前通过分类器进行区分——
其中一组在治疗前显示高的主要组织相容性复合体表达、有第三淋巴结样结构的证据,并在治疗前表现出抗肿瘤免疫力。另一组应答者在基线时类似于无应答者,并只有在组合疗法后才产生最大的免疫反应,其特征是细胞毒性T细胞和抗原呈递的髓系细胞相互作用,这在三阴性乳腺癌小鼠模型中得到了验证。
https://doi.org/10.1016/j.ccell.2023.12.012
3.(Advanced Materials,IF: 29.4)“仿生” 肿瘤钙化引导的肝细胞癌早诊与根除

肿瘤钙化(Tumor Calcification)被发现与良性预后相关,并在临床上显示出作为肿瘤反应的一种相对预测指标的巨大潜力。然而,在临床癌症治疗中,钙化仍然是一个缺失的领域。研究人员提出了一种通过CaO2基微球和经导管动脉栓塞(TAE)协同作用诱导肿瘤钙化的特定策略,用于肝细胞癌(HCC)的治疗。
持续的原位钙应激会导致强大的肿瘤钙凋亡,导致弥漫性钙化和计算机断层扫描(CT)上的高密度阴影,从而能够清晰地定位体内肿瘤部位,并在原位HCC兔模型中部分勾画肿瘤边缘。这种渗透性钙化有助于肿瘤的临床诊断,在早期随访期间对区分肿瘤反应具有重要意义。
蛋白质组和磷酸蛋白组分析确定了钙网蛋白(CALR)是参与肿瘤钙化的关键靶标蛋白。进一步的荧光分子成像分析还表明,CALR可以作为钙化的前兆标志物,以预测不同临床前啮齿动物模型的早期肿瘤反应。该研究结果表明,与肿瘤钙化相关的CALR上调可能广泛用于肿瘤反应的快速可视化。
https://doi.org/10.1002/adma.202310818
4.(ACS Nano,IF: 17.1)胶质母细胞瘤干细胞的小细胞外囊泡的多组学分析

胶质母细胞瘤是一种致命的脑肿瘤,目前尚无治愈方法。胶质母细胞瘤干细胞(GSCs)的存在导致了该病的异质性,使得开发有效的治疗方案具有挑战性。胶质母细胞瘤细胞目前已被证明可以通过释放称为细胞外囊泡(EV)的生物纳米结构来影响其环境。
在该研究中,研究人员研究了GSC源的纳米级EVs(<200 nm)在胶质母细胞瘤的异质性、可塑性和侵袭性中的作用,特别关注它们的蛋白质、代谢物和脂肪酸含量。研究人员发现,来自一个胶质母细胞瘤亚型的细胞的条件培养基和小细胞外囊泡(sEVs)诱导了另一个亚型细胞的转录组和蛋白质组的变化。他们发现,GSC源的sEVs富集了在氨基酸、羧酸和有机酸的跨膜转运,生长因子结合以及与氨基酸、羧酸和糖代谢相关的代谢物中发挥作用的蛋白质。这表明了GSC源的sEVs在为邻近的GSCs提供有价值的代谢物和负责其转运的蛋白质方面具有双重作用。
此外,研究人员还发现GSC源的sEVs富含饱和脂肪酸,而它们相应的细胞富含不饱和脂肪酸,支持生物载体装载到sEVs的过程是一个高度调节的过程,并且GSC源的sEVs可能是维持胶质母细胞瘤细胞代谢所需饱和脂肪酸的来源。有趣的是,从倾向于神经源性和间质性亚型的GSCs中分离的sEVs富含特定的蛋白质、代谢物和脂肪酸集合,表明转录上不同的胶质母细胞瘤细胞之间存在分子合作。
总的来说,这项研究揭示了GSC源的sEV的复杂性,并揭示了它们在肿瘤异质性和胶质母细胞瘤中关键细胞过程失调方面的潜在贡献。
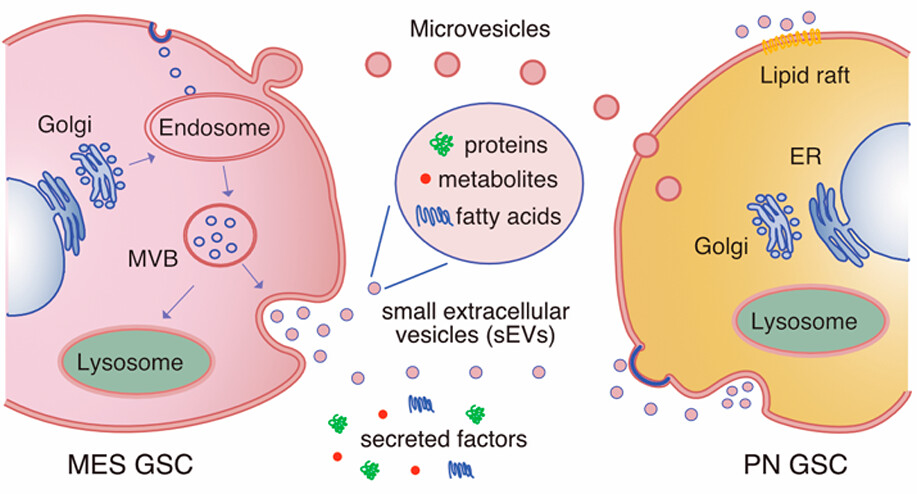
https://doi.org/10.1021/acsnano.3c11427
5. (Microbiome,IF: 15.5)胃癌舌苔宏蛋白组分析的多中心诊断研究

先前的研究表明,胃癌患者和非胃癌患者的舌像存在明显差异。然而,舌象作为一种疾病指标的生物学机制仍然不清楚。舌苔是舌背上的可见层,是舌头外观的一个主要因素,为口腔微生物提供了重要的生存环境。虽然口腔微生物与胃肠疾病相关,但人们对口腔微生物群的综合功能特征仍不完全了解。宏蛋白组学在揭示微生物群功能特征方面具有独特的优势,有助于理解特定舌苔形成的机制及其作为胃癌指标的作用。
研究人员采用压力循环技术和数据非依赖性采集(PCT-DIA)质谱技术,从中国5个独立研究中心的180名胃癌患者和185名非胃癌患者中提取和鉴定舌苔蛋白。他们从345份舌苔样本中测定了1432种人源蛋白和13,780种微生物蛋白,并发现舌苔蛋白质的丰度在个体内部表现出高度的时间稳定性。他们观察到胃癌患者舌表面的人类角蛋白 KRT2 和 KRT9 下调,微生物群中的 ABC 转运体 COG1136 也下调。这表明舌粘膜的防御能力下降。最后,他们建立了一个机器学习模型,利用舌苔上的 50 种微生物蛋白来识别胃癌高危人群,在独立验证队列中的曲线下面积(AUC)达到了 0.91。
总的来说,该研究描述了胃癌患者舌苔蛋白的变化特征,并构建了基于微生物衍生的舌苔蛋白的胃癌筛查模型。结果表明,舌苔蛋白是识别胃癌高危人群的潜在指标。
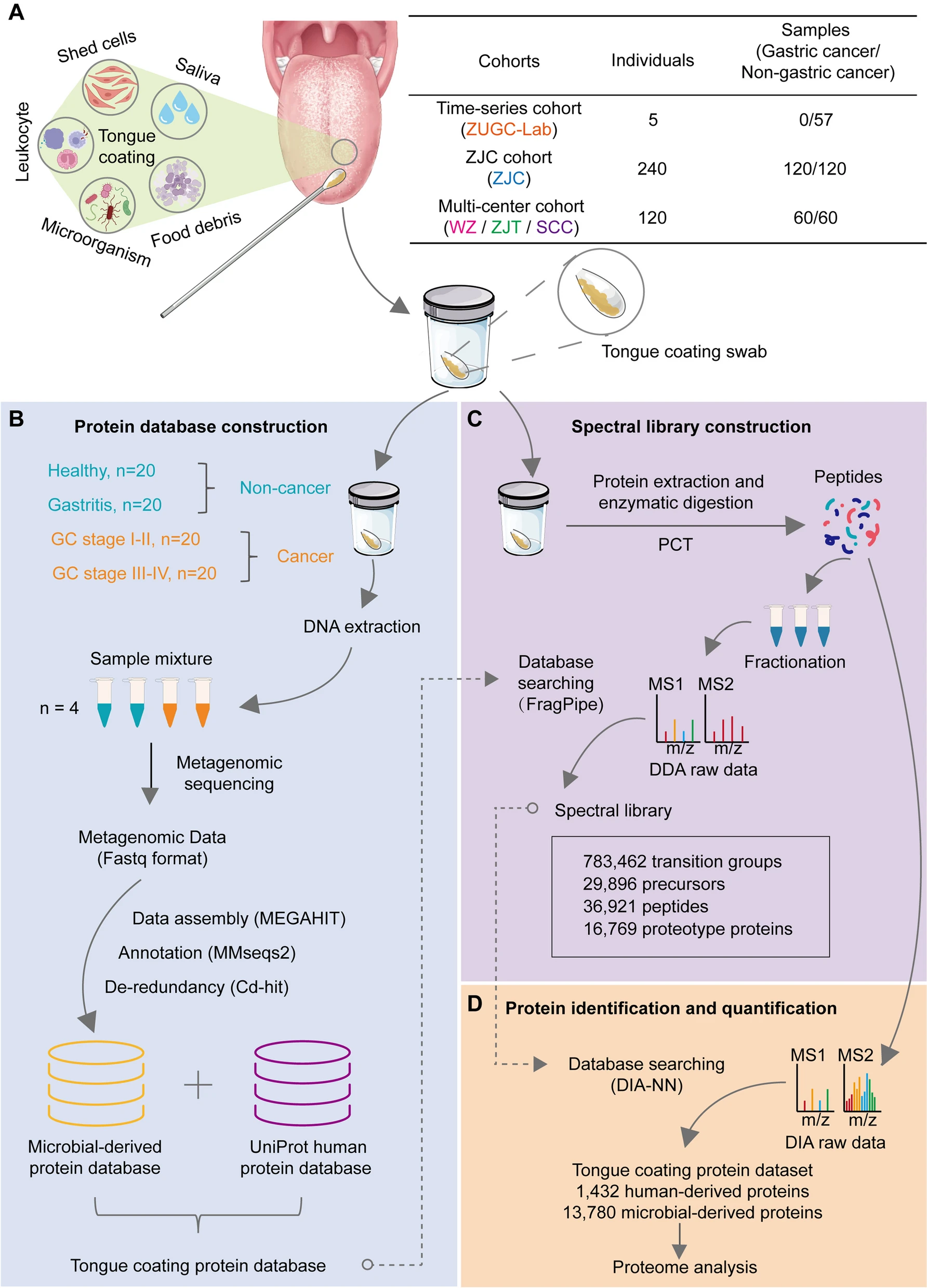
https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-023-01730-8
6. (Cancer Discovery,IF: 28.2)乘客基因共扩增造成癌症的附带治疗漏洞

癌症中的DNA扩增不仅包含癌基因。在该研究中,研究人员试图确定乘客基因的共同扩增是否会导致附带的治疗性脆弱性。通过对3,000多个癌症基因组的分析,然后通过对700多个癌细胞系的CRISPR-Cas9失活筛选的探讨,研究人员发现乘客基因的共同扩增伴随着不同的依赖性特征。
在一项原理验证研究中,他们证明了真正的乘客基因DEAD-Box Helicase 1(DDX1)的共同扩增会增加对mTOR通路的依赖性。相互作用蛋白质组学识别了三羧酸循环(TCA)组分是以前未被发现的DDX1相互作用伙伴。活细胞代谢组学强调这种相互作用可能影响TCA活性,从而导致mTORC1活性增强。因此,遗传和药物干预破坏mTORC1在体外和体内均导致显著的细胞死亡。因此,乘客基因和癌基因在结构上的共同扩增可能导致附带的脆弱性。
https://doi.org/10.1158/2159-8290.CD-23-1189
7. (Nature Methods,IF:48)SnapATAC2:用于分析单细胞组学数据的快速、可扩展多功能工具

单细胞组学技术已经彻底改变了对复杂组织中基因调控的研究。在分析这些数据集时,一个主要的计算挑战是将大规模和高维度的数据投影到低维度空间,同时保持细胞之间的相对关系。这种低维度嵌入对于分解细胞异质性并重构特定细胞类型的基因调控程序是必要的。然而,传统的降维技术在计算效率和全面解决不同分子模式下的细胞多样性方面面临挑战。
该研究介绍了一种非线性降维算法,该算法体现在Python软件包SnapATAC2中,它不仅实现了对单细胞组学数据异质性更精确的捕捉,还确保了高效的运行时和内存使用,并与细胞数量成线性比例。
该工具在各种单细胞组学数据集中都展现了卓越的性能、可扩展性和多功能性,包括单细胞转座酶可及染色质测序、单细胞RNA测序、单细胞Hi-C和单细胞多组学数据集,表明了它在推进单细胞分析方面的实用性。
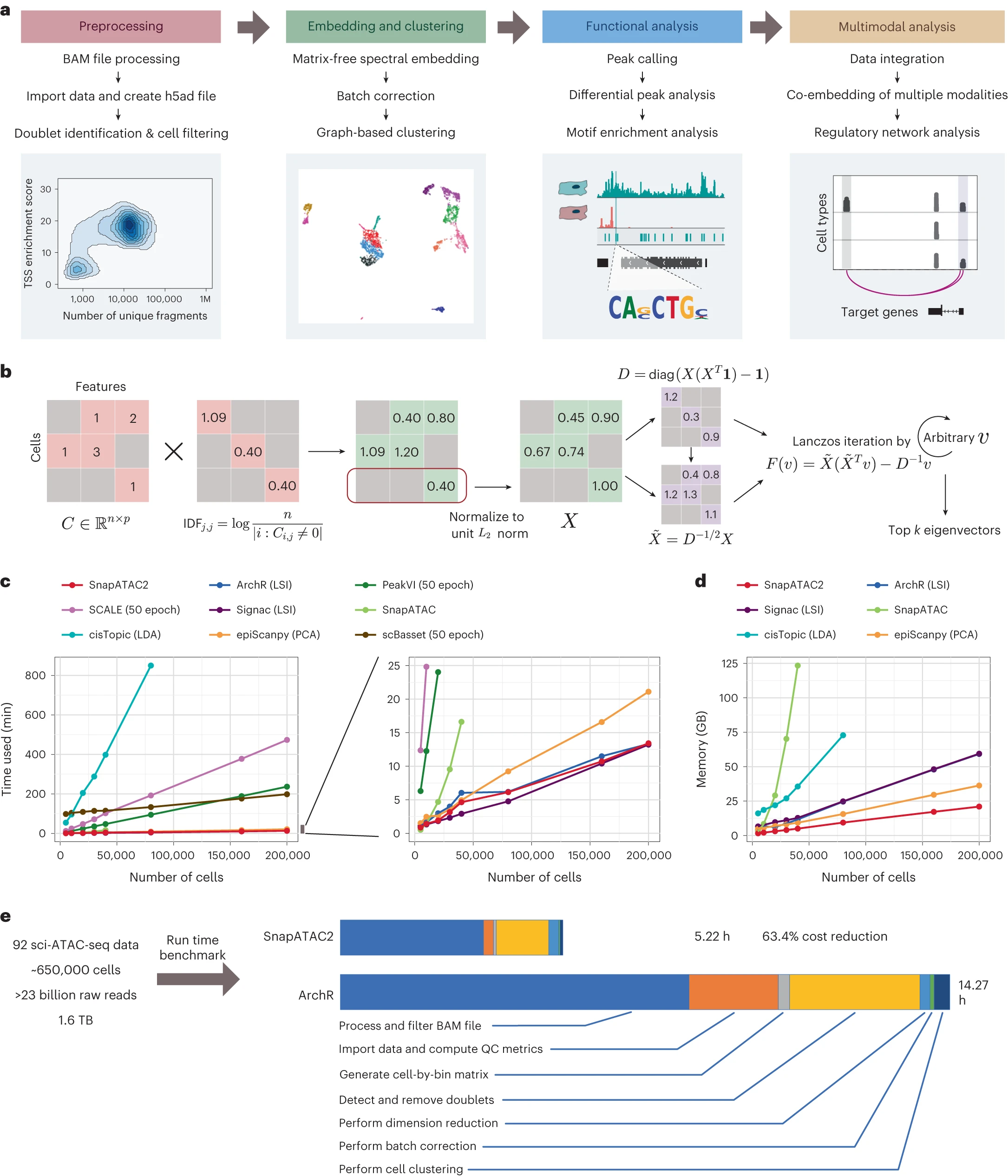
https://www.nature.com/articles/s41592-023-02139-9
8. (Nature Communications,IF:16.6)定量蛋白组学揭示改良安卡拉痘苗病毒感染期间的抗病毒防御和细胞死亡机制

改良安卡拉痘苗(MVA)病毒不会在人体细胞中复制,并被用作遏制当前猴痘疫情的疫苗。
研究人员进行了一项多重蛋白质组学分析,对人成纤维细胞和巨噬细胞感染 MVA 病毒的整个过程中的 9000 多种细胞蛋白质和约 80% 的病毒蛋白质进行了定量分析。结果显示,超过690 个人类蛋白受 MVA 下调超过 2 倍,揭示了宿主蛋白质组的大幅重塑。其中超过 25% 的 MVA 靶点与具有复制能力的痘苗病毒不同。病毒中间/晚期基因表达是 MVA 拮抗先天性免疫的必要条件,而对 ISG20 等干扰素效应蛋白的抑制增强了病毒基因的表达。针对巨噬细胞感染特异的蛋白质组学变化表明对炎症反应的调节,包括炎症小体的激活。
因此,该研究提供了关于MVA对人体蛋白质组的影响的全局视图,并确定了可能支持其顿挫感染的机制。这些发现对于设计未来疫苗至关重要。
https://www.nature.com/articles/s41467-023-43299-8









